题目内容
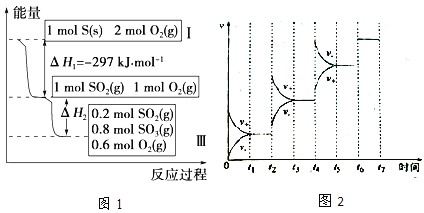
【题目】恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示:[已知:2SO2(g)+O2(g) ![]() 2SO3(g);△H=-196.9kJ/mol]
2SO3(g);△H=-196.9kJ/mol]
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:_______________________;△H2=_______________;
(2)恒温恒容时,1molSO2和2molO2充分反应,放出热量的数值比|△H2|______(填 “大”、“小”或“相等”).
(3)恒容条件下,下列措施中能使n(SO3)/n(SO2)增大的有______。
a.升高温度 b.充入He气 c.再充入1molSO2(g)和1molO2(g) d.使用催化剂
(4)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是______;图中表示平衡混合物中SO3的含量最高的一段时间是______。
(5)含硫废弃的脱硫减排是减少大气中含硫化合物污染的关键,工业脱除废气中SO2的原理如下:
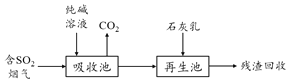
①用纯碱溶液吸收SO2,将其转化为HSO3-,该反应的离子方程式为___________________________;
②若石灰乳过量,将其产物再导入吸收池,其中可用于吸收SO2的物质的电子式是____________。
【答案】 S(s)+O2(g)=SO2(g) △H= -297 kJ/mol -78.64kJ/mol 大 c 升高温度 t3t4 2SO2 +H2O+CO32-=2HSO3-+CO2↑ ![]()
【解析】(1)燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,所以,硫的物质的量为1mol.由图1可知1molS(s)完全燃烧放出的热量为297KJ,所以,硫的燃烧热的热化学方程式S(s)+O2(g)═SO2(g)△H=-297KJmol-1;由图1可知,参加反应的n(SO2)=1mol-0.2mol=0.8mol,根据热化学方程式:2SO2(g)+O2(g)2SO3(g)△H=-196.6kJmol-1;可知,△H2=0.4△H=0.4×(-196.6kJmol-1)=-78.64KJmol-1;
(2)恒温恒容时,开始为1molSO2和2molO2与开始为1molSO2和1molO2相比,增大氧气的浓度,平衡正向移动,所以开始为1molSO2和2molO2的SO2转化率高,放出热量的数值比|△H2|大;
(3)A.反应为放热反应,温度升高,平衡逆向移动,n(SO3)减小,n(SO2)增大,n(SO3)/n(SO2)减小,故A错误;B.恒容条件下,充入氦气,反应混合物浓度不变,平衡不移动,n(SO3)/n(SO2)不变,故B错误;C.通入充入1mol SO2(g)和0.5mol O2(g)相当于加压,平衡右移,再通入0.5mol O2(g),平衡进一步右移,n(SO3)/n(SO2)增大,故C正确;D.使用催化剂,加快反应,平衡不移动,n(SO3)/n(SO2)不变,故D错误;故答案为C;(4)t2~t3段正逆速率都加快,且v(正)>v(逆),平衡正向移动.t4~t5段正逆速率都加快,且v(正)<v(逆),平衡逆向移动.该反应为体积减小的放热反应,若升高温度,平衡逆向移动,若增大压强,平衡正向移动,故t2~t3段为增大压强,t4~t5段为升高温度;t2~t3段为增大压强后,平衡正向移动,SO3的含量升高,至t3~t4平衡时含量达最高;
(5)①碳酸钠溶液中通入过量的二氧化硫反应生成亚硫酸氢钠和二氧化碳,离子方程式:H2O+2SO2+CO32-═2HSO3-+CO2↑;②二氧化硫为酸性氧化物,能够与氢氧化钠溶液反应,NaOH的电子式为![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】Ca3N2某实验小组利用如下装置(部分固定装置略)进行氮气与钙的反应,并探究其产物的性质及化学式。请回答下列问题。

(1)仪器B的名称是_____________,B中固体物质为_______________。
(2)反应过程中末端导管必须插入试管C的水中,目的是______。(填字母)
A.吸收反应中剩余的氮气
B.控制通入气体的流速
C.防止空气中的氧气倒流进入反应装置,干扰反应
(3)将制备氮化钙的操作步骤补充完整:
①打开活塞K并通入N2;
②点燃酒精灯,进行反应;
③反应结束后,__________________。
(4)该小组同学认为根据相应的质量关系可以求出生成物的化学式,数据记录如下:
A的质量m0/g | A与钙的质量m1/g | A与产物的质量m2/g |
14.80 | 15.08 | 15.15 |
①通过计算得到化学式CaxN2,其中x=______。
②小组同学查阅资料得知产物为Ca3N2,能与水强烈反应,请写出Ca3N2与水反应的化学方程式_________________,设计实验检验Ca3N2与水反应产物的操作及现象__________________。
【题目】下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
选项 | A | B | C | D |
强电解质 | Fe | NaCl | CaCO3 | HNO3 |
弱电解质 | CH3COOH | NH3 | H3PO4 | Fe(OH)3 |
非电解质 | 蔗糖 | BaSO4 | 酒精 | H2O |

