题目内容
(共16分)
Ⅰ实验室制备1,2-二溴乙烷的反应原理如下:
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。
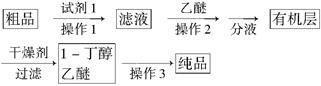
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:
有关数据列表如下: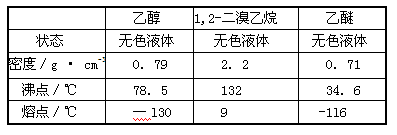
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)若产物中有少量副产物乙醚.可用 的方法除去;
(4)反应过程中应用冷水冷却装置D,其主要目的是避免溴大量挥发,但又不能过度冷却(如用冰水),其原因是 。
Ⅱ.已知烯烃与苯在一定条件下反应生成芳香烃。如:
丙烯是三大合成材料的基本原料,可用于合成应用广泛的DAP树脂单体和双酚等有机物,具有重要的工业用途。
(1)写出丙烯在一定条件下发生聚合反应的化学方程式 。
(2)丙烯在乙酸作用下与O2反应生成有机物A,其蒸气密度是相同状况下甲烷密度的6.25倍,元素的质量分数为:碳60%、氧32%。A的分子式为 。
(3)丙烯与苯在一定条件下反应可生成D、E、F等多种芳香烃。红外光谱、核磁共振是研究有机物结构的重要方法,根据下列数据,画出D、E的结构。
D:元素组成:C89.94%、H10.06%;1H核磁共振有5个信号。
E:元素组成:C88.82%、H11.18%;1H核磁共振有3个信号。
F:元素组成:C88.82%、H11.18%;1H核磁共振有4个信号。
D: 。 E: 。
(每空2分,共16分)
Ⅰ: (1)d (2)c (3)蒸馏
(4)产品1,2-二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管。
Ⅱ
(1)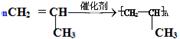 (2分)
(2分)
(2) C5H8O2
(3) 
解析试题分析:Ⅰ(1)已知乙醇在浓硫酸的存在下在l40℃脱水生成乙醚,故迅速地把反应温度提高到170℃左右的主要目的是减少副产物乙醚生成,故选d。
(2)酸性气体是二氧化硫,故c中应加入氢氧化钠溶液,故选c。
(3)乙醚和1,2-二溴乙烷的沸点相差很大,故可用蒸馏的方法除去副产物乙醚。
(4)由表中可知1,2-二溴乙烷的熔点为9℃,若温度过低,1,2-二溴乙烷会凝固而堵塞导管。
Ⅱ(1)丙烯与乙烯都含有碳碳双键,聚合反应的原理是相同的,故化学方程式为: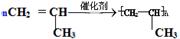 。
。
(2)A的相对分子质量为16*6.25=100,经过计算C、H、O的物质的量分别为5mol、8mol、2mol,故A的分子式为C5H8O2。
(3)D:H原子有5种等效氢,经过计算是一个丙烯与苯发生的反应,结构式为: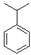 。
。
E:H原子有3种等效氢,经过计算是二个丙烯与苯发生的反应,结构式为: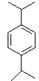 。
。
考点:有机物的性质
点评:本题以实验题的形式考查了有机物的性质,难度适中,注意分析题中所给出的信息,便能解答此题。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案(共16分)在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过_____________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_______(填写下列编号字母)的净化装置。
(A)碱石灰 (B)饱和食盐水 (C)浓硫酸 (D)饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:____________________________。
反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是__________(填写实验操作名称)。
(3)本实验中制取次氯酸钠的离子方程式是______________________________________。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为_______色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | _______________________________ |
| 然后溶液从无色逐渐变为_______色 | _______________________________ |




 CH3CH2CH2CHO
CH3CH2CH2CHO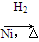 CH3CH2CH2CH2OH:
CH3CH2CH2CH2OH: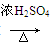 CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。