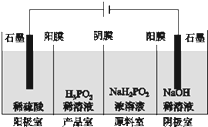
题目内容
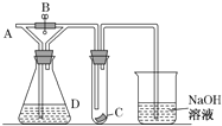
【题目】如图所示,若电解5 min时,测得铜电极的质量增加2.16 g。试回答:

(1)电源中X极是________(填“正”或“负”)极。
(2)通电5 min时,B中共收集到224 mL(标准状况)气体,溶液体积为200 mL(电解前后溶液的体积变化忽略不计),则通电前c(CuSO4)=________。
(3)若A中KCl溶液的体积也是200 mL,电解后溶液中仍有Cl-,则电解后溶液的c(OH-)=________。
(4)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气合成为甲醇,甲醇是汽车燃料电池的重要燃料。已知氢气、甲醇燃烧的热化学方程式如下:
2H2(g)+O2(g)===2H2O(l) ΔH=-570 kJ·mol-1 ①
2CH3OH(l)+ 3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1 ②
写出二氧化碳与氢气合成甲醇液体的热化学方程式:_________________________________。
【答案】 负 0.025 mol·L-1 0.1mol/L CO2(g)+3H2(g)===CH3OH(l)+H2O(l) ΔH=-129 kJ·mol-1
【解析】(1)由铜电极的质量增加,发生![]() ═Ag,则Cu电极为阴极,可以知道X为电源的负极;正确答案:负。
═Ag,则Cu电极为阴极,可以知道X为电源的负极;正确答案:负。
(2)C中阴极反应为![]() ═Ag,
═Ag,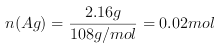 ,则转移的电子为
,则转移的电子为![]() ,B中阳极反应为
,B中阳极反应为![]() ═
═![]() ,则转移
,则转移![]() 电子生成氧气为
电子生成氧气为![]() ,其体积为
,其体积为![]() ,则在阴极也生成
,则在阴极也生成![]() 气体,由
气体,由![]() ═
═![]() ,则氢气的物质的量为
,则氢气的物质的量为![]() ,该反应转移的电子为
,该反应转移的电子为![]() ,则
,则![]() ═Cu中转移
═Cu中转移![]() 电子,所以
电子,所以![]() 的物质的量为
的物质的量为![]() ,通电前
,通电前![]() ;正确答案:
;正确答案:![]() 。
。
(3)由A中发生![]() ,由电子守恒可以知道,转移
,由电子守恒可以知道,转移![]() 电子时生成
电子时生成![]() ,忽略溶液体积的变化,则
,忽略溶液体积的变化,则![]() ,正确答案:0.1mol/L。
,正确答案:0.1mol/L。
(4)由①2H2(g)+O2(g)===2H2O(l) ΔH=-570 kJ·mol-1 ;②2CH3OH(l)+ 3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1;根据盖斯定律:(3×①-②)/2,可得:CO2(g)+3H2(g)===CH3OH(l)+H2O(l) ΔH=-129 kJ·mol-1;正确答案:CO2(g)+3H2(g)===CH3OH(l)+H2O(l) ΔH=-129 kJ·mol-1。

 阅读快车系列答案
阅读快车系列答案