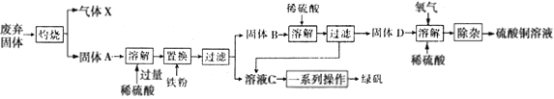
题目内容
【题目】某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质,以C4H10为燃料,该电池工作原理如图。下列说法正确的是( )
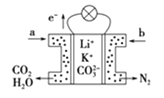
A.a为C4H10,b为CO2
B.在熔融电解质中,CO32-向正极移动
C.此电池在常温时也能工作
D.通入丁烷的一极是负极,电极反应式为C4H10-26e-+13CO32-=17CO2↑+5H2O
【答案】D
【解析】
A.燃料电池中通入燃料的电极是负极、通入氧化剂的电极是正极,根据电子流向知,左边电极是负极、右边电极是正极,所以a为![]() ,b为
,b为![]() ,故A错误;
,故A错误;
B.原电池放电时,阴离子移向负极,故CO32-向负极移动,故B错误;
C.电解质为熔融碳酸盐,需要高温条件,常温下不能工作,故C错误;
D.通入丁烷的一极是负极,发生失电子的氧化反应,电极反应式为C4H10-26e-+13CO32-=17CO2↑+5H2O,故D正确;
故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
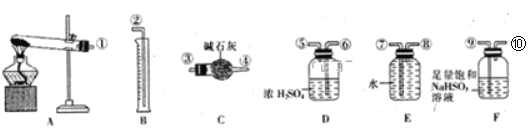
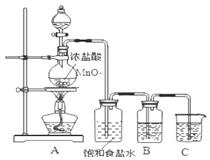
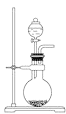
小学生10分钟应用题系列答案【题目】I.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学们分别设计了如下图甲、乙所示的实验装置。请回答相关问题:
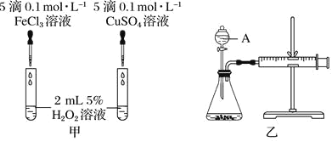
(1)定性甲所示装置可通过观察_________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_________。
(2)定量如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为_______,实验中需要测量的数据是________。
II.以下是某研究小组探究影响反应速率部分因素的相关实验数据。
实验 序号 | H2O2溶液浓度/% | H2O2溶液体积/mL | 温度/℃ | MnO2用量/g | 收集O2的体积/mL | 反应所需时间/s |
① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
③ | 30 | 5 | 35 | 2 | 49.21 | |
④ | 30 | 5 | 2 | 10.76 |
(3)通过实验①和②对比可知,化学反应速率与_____有关;从实验③和④对比可知,化学反应速率与温度的关系是_____。