题目内容
16.氮族元素包括N、P、As、Sb和Bi五种元素,它们的单质和化合物在生产与生活有重要作用.(1)下列关于氮族元素的说法正确的是BDF.
A.N2可用于填充霓虹灯,其发光原理是原子核外电子从能量较低的轨道跃迁到能量较高的轨道,以光的形式释放能量.
B.氮族元素属于p区元素,第一电离能比同周期的碳族和氧族元素大.
C.Bi原子中最外层有5个能量相同的电子.
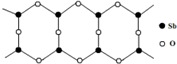
D.Sb的一种氧化物高于843K时会转化为长链的大分子,其结构片段如图,则该分子中Sb、O的原子个数比为2:3.
E.BN有晶体和非晶体型两种,它们本质区别是:晶体具有各向异性,而非晶体则具有各向同性.
F.液氨中氢键的键长是指N-H…N的长度.
(2)Na3AsO4可作杀虫剂.AsO43-的空间构型为正四面体,与其互为等电子体的一种分子为CCl4.
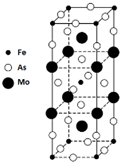
(3)王亚愚研究组在铁砷化合物(FexMoyAsz)绝缘相电子结构研究方面取得进展,已知:Mo位于第五周期VIB族.
①Mo元素基态原子的价电子排布式为4d55s1.
②铁砷化合物晶胞结构如图,已知x=1,则y=2,若Fe的化合价为+2价,As为-3价,则Mo的化合价为+5.
分析 (1)A.根据能量守恒和电子能级跃迁原理,只有当电子从能量较高的轨道跃迁到能量较低的轨道,才能以光的形式释放能量;
B.同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第VA族第一电离能大于其相邻元素;
C.Bi原子最外层有2个5s能级电子、3个5p能级电子;
D.根据图知,1个环上含有2个Sb原子、3个O原子;
E.晶体与非晶体的本质区别是:其内部粒子在空间上是否按一定规律做周期性重复排列;
F.氢键的键长是指X-H…Y的长度;
(2)该微粒中As原子价层电子对个数是4+$\frac{1}{2}$×(5+3-4×2)=4,且不含孤电子对,根据价层电子对互斥理论确定微粒空间构型;原子个数相等、价电子数相等的微粒互为等电子体;
(3)①Mo原子序数为42号元素,其原子核外有42个电子,该原子4d、5s能级电子为其价电子;
②该晶胞中,Fe原子个数=1+8×$\frac{1}{8}$=2,As原子个数=16×$\frac{1}{4}$+2+4×$\frac{1}{2}$=8,Mo原子个数=2+8×$\frac{1}{4}$=4,则该晶胞中Fe、As、Mo原子个数之比=2:8:4=1:4:2,则其化学式为FeMo2As4;化合物中各元素化合价的代数和为0,从而确定Mo元素化合价.
解答 解:(1)A.根据能量守恒和电子能级跃迁原理,只有当电子从能量较高的轨道跃迁到能量较低的轨道,才能以光的形式释放能量,从低能量高低跃迁到高能量高低,需要吸收能量,故A错误;
B.同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第VA族第一电离能大于其相邻元素,所以电离能N>O>C,故B正确;
C.Bi原子最外层有2个5s能级电子、3个5p能级电子,所以Bi原子最外层电子能量不完全相同,故C错误;
D.利用均摊法计算,根据图知,1个环上含有2个Sb原子、3个O原子,所以Sb、O原子个数之比为3:2,故D正确;
E.晶体与非晶体的本质区别是:其内部粒子在空间上是否按一定规律做周期性重复排列,故E错误;
F.氢键的键长是指X-H…Y的长度,则液氨中氢键的键长是指N-H…N的长度,故F正确;
故选BDF;
(2)该微粒中As原子价层电子对个数是4+$\frac{1}{2}$×(5+3-4×2)=4,且不含孤电子对,根据价层电子对互斥理论确定微粒空间构型为正四面体构型;原子个数相等、价电子数相等的微粒互为等电子体,则与AsO43-互为等电子体的是CCl4;
故答案为:正四面体;CCl4;
(3)①Mo原子序数为42号元素,其原子核外有42个电子,该原子4d、5s能级电子为其价电子,其价电子排布式为4d55s1,故答案为:4d55s1;
②该晶胞中,Fe原子个数=1+8×$\frac{1}{8}$=2,As原子个数=16×$\frac{1}{4}$+2+4×$\frac{1}{2}$=8,Mo原子个数=2+8×$\frac{1}{4}$=4,则该晶胞中Fe、As、Mo原子个数之比=2:8:4=1:4:2,则其化学式为FeMo2As4,则y=2;
化合物中各元素化合价的代数和为0,Mo元素化合价=$\frac{3×4-2×1}{2}$=+5,
故答案为:2;+5.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、原子核外电子排布、空间构型判断等知识点,难点是晶胞计算,注意:每个原子被几个晶胞占有是确定化学式的关键,同时考查学生空间想象能力.

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案| A. | 合金 | B. | 复合材料 | C. | 纯净物 | D. | 有机材料 |
| A. | 基态铜原子的价电子排布图: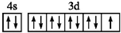 | |
| B. | CO2分子立体结构模型: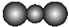 | |
| C. | 三氟化硼的电子式: | |
| D. | 35Br基态原子的电子排布式可简写为[Ar]4s24p5 |


根据各图表示的结构特点,下列有关叙述正确的是( )
| A. | 通常状况下在水中溶解度丙大于丁 | |
| B. | 甲、乙、丙为非极性分子,丁为极性分子 | |
| C. | 甲的水溶液中存在4种氢键 | |
| D. | 甲中电负性小的元素与丙中电负性大的元素形成的化合物一定不存在极性键 |
 硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个有一个奇迹.
硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个有一个奇迹.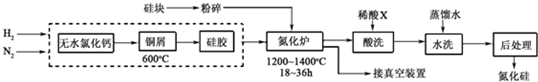
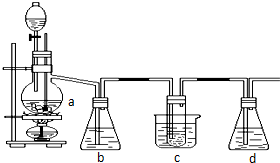 1、2-二溴乙烷可作汽油抗爆剂,常温下它是无色液体,密度2.18g/cm3,沸点131.4 0C,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室可以用下图所示装置制备1、2-二溴乙烷,其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管c中装有浓溴水.
1、2-二溴乙烷可作汽油抗爆剂,常温下它是无色液体,密度2.18g/cm3,沸点131.4 0C,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室可以用下图所示装置制备1、2-二溴乙烷,其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管c中装有浓溴水.