题目内容
【题目】某基态原子的3d能级中有一个电子,则其第四电子层中的电子数为( )
A.0B.2C.3D.8
【答案】B
【解析】
根据构造原理,电子填充顺序为4s、3d、4p、5s、4d、5p、6s、4f、5d、6p,核外电子排满4s再排3d,3d能级中有一个电子,不存在洪特规则特例情况,s能级最多容纳2个电子,因此4s上的电子数为2。
答案为B。

 鹰派教辅衔接教材河北教育出版社系列答案
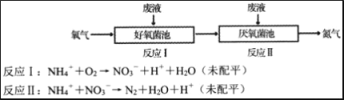
鹰派教辅衔接教材河北教育出版社系列答案【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
则下列说法正确的是
A.△H1<0,△H2>0
B.反应①②③的反应热满足关系:△H2-△H1=△H3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施
【题目】回答下列问题:
(1)若金属钠等活泼金属着火时,应该用_______________来灭火。将一小块钠投入盛有饱和石灰水的烧杯中,不可能观察到的现象是________。
a.有气体生成 b.钠熔化成小球并在液面上游动
c.烧杯底部有银白色的金属钙生成 d.溶液变浑浊
(2)Na2CO3和NaHCO3是两种常见的钠盐。下列关于Na2CO3和NaHCO3性质的说法中,正确的是______________。
a.常温下,Na2CO3在水中的溶解度比NaHCO3小
b.相同质量的Na2CO3和NaHCO3分别与足量盐酸反应,在相同条件下产生CO2前者多
c.可用Ca(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液
d. NaHCO3溶液中混有少量Na2CO3杂质可通入足量CO2除杂
(3)过氧化钠、过氧化镁都是重要的过氧化物。过氧化镁不溶于水,但易溶于稀酸,广泛用作胃药,治疗胃酸过多。试写出过氧化镁与胃酸反应的离子方程式:_____________。
(4)某无色稀溶液X中,可能含有Al3+、Cl-、Fe3+、Mg2+、NH4+中的某几种,向其中加入NaOH溶液时产生沉淀的物质的量(n)与加入NaOH溶液体积(V)的关系如下图所示。
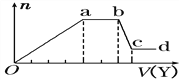
则X中一定含有的阳离子是_________,bc段反应的离子方程式为________。
(5)在1L某酸性溶液中离子浓度的分析结果如下表
离子 | Mg2+ | Al3+ | SO42 | Cl |
c/(mol/L) | 0.5×102 | 1.0×102 | 0.5×102 | 3.0×102 |
向该溶液中逐滴加入0.5 molL-1NaOH溶液至沉淀恰好不再溶解时,消耗NaOH体积为_____mL。