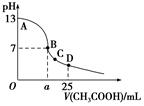
题目内容
25℃时,相同体积和pH的NaX、NaY、NaZ三种盐溶液,分别加水稀释,溶液pH的变化与所加水的体积关系如图所示。下列说法正确是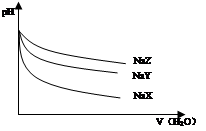
| A.在上述三种盐原溶液中,水的电离度大小是NaX>NaY>NaZ |
| B.在等物质的量浓度的NaX、NaY、NaZ混合液中,离子浓度的大小关系是c(Z-)>c(Y-)>c(X-) |
| C.在上述NaX和NaY的混合液中存在c(HX)/c(X-)=c(HY)/c(Y-) |
| D.在0.2mol·L-1 NaX溶液中加入等体积0.1mol·L-1的盐酸,所得混合液中存在c(H+)+c(HX)=c(OH-)+c(Cl-) |
D
解析试题分析:加水稀释促进盐类水解,稀释相同的倍数时,pH变化越大说明该盐的水解程度越小,其相对应的酸酸性越强,所以这三种酸的强弱顺序是HX、HY、HZ,则酸根离子水解程度大小顺序是Z->Y->X-,酸根离子水解程度越大,水的电离程度越大,所以水的电离度大小是NaX<NaY<NaZ,故A错误;等物质的量浓度的NaX、NaY、NaZ混合液中,酸根离子水解程度越大,其溶液中酸根离子浓度越小,所以离子浓度的大小关系是c(Z-)<c(Y-)<c(X-),故B错误;酸的电离程度不同,则其水解程度不同,所以该选项错误,故C错误;溶液中的溶质是等物质的量浓度的NaX、NaCl、HX,根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(Cl-)+c(X-),根据物料守恒得c(Na+)=c(HX)+c(X-)=2c(Cl-),所以得c(H+)+c(HX)=c(OH-)+c(Cl-),故D正确;故选D。
考点:本题考查了盐类水解,根据图片曲线变化趋势正确判断酸的强弱是解本题关键,再结合盐类水解、电荷守恒来分析解答即可,难度中等。

下列叙述不正确的是
| A.相同物质的量浓度的①CH3COONa溶液②NaNO3溶液③NH4Cl溶液④NaOH溶液,pH的大小顺序是:④>①>②>③ |
| B.在Na2SO3和NaHSO3混合液中:c(Na+)+c(H+)=c(HSO3-)+c(OH-)+2c(SO32-) |
| C.相同条件下,pH=10的CH3COONa溶液和氨水中,由水电离出的c(OH-)前者大于后者 |
| D.某溶液中只含Na+、CH3COO-、H+、OH-四种离子,则溶液一定呈现碱性 |
25℃时,水溶液中c(H+)与c(OH-)的变化关系如图中曲线a c所示,下列判断错误的是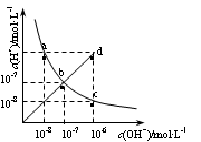
| A.a c曲线上的任意一点都有c(H+)·c(OH-)=10-14 |
| B.b d线段上任意一点对应的溶液都呈中性 |
| C.d点对应溶液的温度高于25℃,pH<7 |
| D.CH3COONa溶液不可能位于c点 |
下列说法正确的是( )
| A.常温下,醋酸钠与醋酸的混合溶液PH=7,C(Na+)>c(CH3COO-) |
| B.0.1mol/LNa2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| C.将PH=6的H2SO4稀释1000倍后,c(H+)=2c(SO42-) |
| D.0.1mol/LNaHCO3溶液中:c(Na+)+c(H+)= c(HCO3-)+ c(OH-)+2c(CO32-) |
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3
主要:Cu2++CO32—+H2O=Cu(OH)2↓+CO2↑
次要:Cu2++CO32—=CuCO3↓
(2)CuSO4+Na2S
主要:Cu2++S2-=CuS↓
次要:Cu2++S2-+2H2O=Cu(OH)2↓+H2S↑
下列几种物质的溶解度大小的比较中,正确的是 ( )
| A.CuS<Cu(OH)2<CuCO3 | B.CuS>Cu(OH)2>CuCO3 |
| C.Cu(OH)2>CuCO3>CuS | D.Cu(OH)2<CuCO3<CuS |
下列电离方程式的书写正确的是 ( )
A.NH4++H2O NH3·H2O+H+ NH3·H2O+H+ |
B.S2-+2H2O H2S+2OH- H2S+2OH- |
C.CH3COOH+H2O CH3COO-+H3O+ CH3COO-+H3O+ |
D.CH3COOH+OH- CH3COO-+H2O CH3COO-+H2O |
25 ℃时,5种银盐的溶度积常数(Ksp)分别是:
| AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
下列说法正确的是 ( )。
A.氯化银、溴化银和碘化银的溶解度依次增大
B.将硫酸银溶解于水后,向其中加入少量硫化钠溶液,不可能得到黑色沉淀
C.在5 mL 1.8×10-5 mol·L-1的NaCl溶液中,加入1滴(1 mL约20滴)0.1 mol·
L-1的AgNO3溶液,不能观察到白色沉淀
D.将浅黄色溴化银固体浸泡在饱和氯化钠溶液中,可以有少量白色固体生成
物质的量浓度相等的4种溶液:①H2S、②NaHS、③Na2S、④H2S和NaHS的混合液。下列说法正确的是( )
| A.溶液pH由大到小的顺序:③>②>①>④ |
| B.c(H2S)由大到小的顺序:①>④>②>③ |
| C.在Na2S溶液中:2c(Na+)=c(H2S)+c(HS-)+c(S2-) |
| D.在NaHS溶液中:c(H+)+c(Na+)=c(OH-)+c(HS-)+c(S2-) |