题目内容
6.A为两种金属组成的合金,发生如图所示的变化: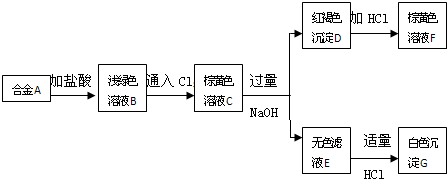
试填写以下空白:
(1)合金A由Al和Fe组成.
(2)写出下列变化的离子方程式.
C→DFe3++3OH-=Fe(OH)3↓;C→EAl3++4OH-=AlO2-+2H2O;
E→GAlO2-+H++H2O=Al(OH)3↓;D→FFe(OH)3+3H+=Fe3++2H2O.
分析 A为两种金属组成的合金,A和稀盐酸反应生成浅绿色溶液B,则B中含有亚铁离子;B中通入氯气得到棕黄色溶液,向C中加入过量NaOH,生成红褐色沉淀D,D为Fe(OH)3;D和稀盐酸反应生成棕黄色溶液F,F中溶质为FeCl3;
无色滤液E中加入适量稀盐酸,得到白色沉淀G,铝离子和过量氢氧化钠生成无色溶液,所以E中含有偏铝酸根离子,G为Al(OH)3,根据元素守恒知,A为Al、Fe合金,B中溶质为FeCl2、AlCl3,C中溶质为AlCl3、FeCl3,
据此分析解答.
解答 解:A为两种金属组成的合金,A和稀盐酸反应生成浅绿色溶液B,则B中含有亚铁离子;B中通入氯气得到棕黄色溶液,向C中加入过量NaOH,生成红褐色沉淀D,D为Fe(OH)3;D和稀盐酸反应生成棕黄色溶液F,F中溶质为FeCl3;无色滤液E中加入适量稀盐酸,得到白色沉淀G,铝离子和过量氢氧化钠生成无色溶液,所以E中含有偏铝酸根离子,G为Al(OH)3,根据元素守恒知,A为Al、Fe合金,B中溶质为FeCl2、AlCl3,C中溶质为AlCl3、FeCl3,
(1)通过以上分析知,A由Al、Fe组成,故答案为:Al、Fe;
(2)C→D是铁离子和氢氧根离子反应生成氢氧化铁沉淀,离子方程式为Fe3++3OH-=Fe(OH)3↓;
C→E是铝离子和氢氧根离子反应生成偏铝酸根离子,离子方程式为Al3++4OH-=AlO2-+2H2O
;
E→G是偏铝酸根离子和氢离子反应生成氢氧化铝沉淀,离子方程式为AlO2-+H++H2O=Al(OH)3↓;D→F是氢氧化铁和氢离子反应生成铁离子和水,离子方程式为Fe(OH)3+3H+=Fe3++2H2O
,
故答案为:Fe3++3OH-=Fe(OH)3↓;Al3++4OH-=AlO2-+2H2O;AlO2-+H++H2O=Al(OH)3↓;Fe(OH)3+3H+=Fe3++2H2O.
点评 本题以Al、Fe及其化合物为载体考查无机物推断,明确物质性质、物质颜色是解本题关键,根据某些物质特殊颜色来分析判断,注意铝离子和氢氧根离子反应量的关系,题目难度不大.

 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案| 选项 | 化学反应与离子方程式 | 评价 |
| A | 将铜屑加入含Fe3+溶液中:Fe3++Cu═Fe2++Cu2+ | 正确 |
| B | Na2O2与H2O反应:Na2O2+H2O═2Na++2OH-+O2↑ | 错误,氧元素不守恒 |
| C | NaOH溶液与氧化铝反应:Al2O3+2OH-═2AlO2-+H2O | 错误,产物应该是Al(OH)3 |
| D | 向稀盐酸中加铁粉:Fe+2H+═Fe3++H2↑ | 正确 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 胶粒直径在1~100nm之间 | B. | 胶粒作布朗运动 | ||
| C. | 胶粒通过吸附而带正电荷 | D. | 胶粒不能透过半透膜 |
| A. | 甲酸甲酯 | B. | 丙酸乙酯 | C. | 蔗糖 | D. | 麦芽糖 |
 ;
; .
. ②
② ③
③ ④
④ ⑤
⑤