题目内容
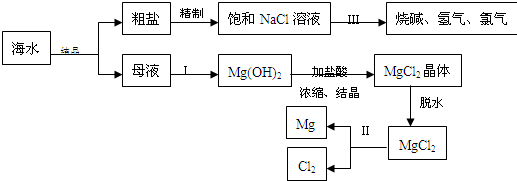
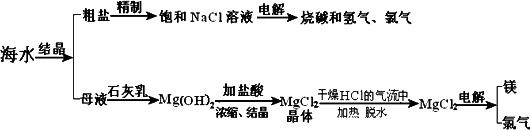
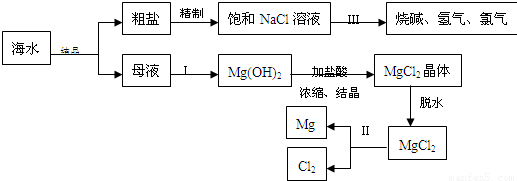
海水中含有非常丰富的化学资源,从海水中可提取多种化工原料.下图是某化工厂对海水资源综合利用的示意图.(注:母液中含有Mg2+)
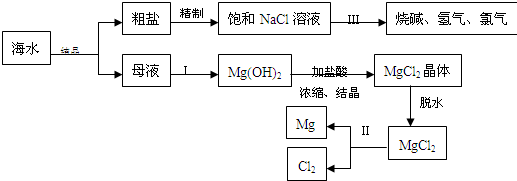
试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制后可得饱和NaCl溶液,精制时通常在溶液中加入以下物质,最后使溶液呈中性.
①过量的Na2CO3溶液、②盐酸、③过量的NaOH溶液、④过量的BaCl2溶液则,加入的顺序是 .
(2)写出加入最后一种试剂后可能发生的化学反应的离子方程式 、 .
(3)①写出反应Ⅱ的化学方程式
②写出反应Ⅲ的离子方程式 .

试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制后可得饱和NaCl溶液,精制时通常在溶液中加入以下物质,最后使溶液呈中性.
①过量的Na2CO3溶液、②盐酸、③过量的NaOH溶液、④过量的BaCl2溶液则,加入的顺序是 .
(2)写出加入最后一种试剂后可能发生的化学反应的离子方程式 、 .
(3)①写出反应Ⅱ的化学方程式
②写出反应Ⅲ的离子方程式 .
(1)SO42-、Ca2+、Mg2+等分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加BaCl2溶液再加Na2CO3溶液,最后加入盐酸,所以正确顺序为④③①②或③④①②或④①③②
(2)因NaOH和Na2CO3过量,能与盐酸反应,所以离子方程式为:H++OH-═H2O; 2H++CO32-═H2O+CO2↑
(3)①反应Ⅱ是电解熔融氯化镁,化学方程式为:MgCl2
Mg+Cl2↑;
②反应Ⅲ为电解饱和食盐水,离子方程式为:2Cl-+2H2O
2OH-+Cl2↑+H2↑;
故答案为:(1)④③①②或③④①②或④①③②
(2)H++OH-═H2O; 2H++CO32-═H2O+CO2↑
(3)①MgCl2
Mg+Cl2↑
②2Cl-+2H2O
2OH-+Cl2↑+H2↑
(2)因NaOH和Na2CO3过量,能与盐酸反应,所以离子方程式为:H++OH-═H2O; 2H++CO32-═H2O+CO2↑
(3)①反应Ⅱ是电解熔融氯化镁,化学方程式为:MgCl2
| ||
②反应Ⅲ为电解饱和食盐水,离子方程式为:2Cl-+2H2O
| ||
故答案为:(1)④③①②或③④①②或④①③②
(2)H++OH-═H2O; 2H++CO32-═H2O+CO2↑
(3)①MgCl2
| ||
②2Cl-+2H2O
| ||

练习册系列答案
相关题目