��Ŀ����
����Ŀ�������ģ������г����۵�ij��ʳ�þ����ΰ�װ����������˵����

���������⻯����ϡ�����ữ�����·������·�Ӧ��KIO3��5KI�� 5H2SO4��3K2SO4�� 3I2��3H2O
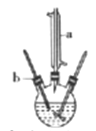
������λͬѧ�ֱ��ò�ͬ�ķ������������100mL 3.6molL��1��ϡ���ᡣ
��1��������18molL��1��Ũ����������Һ����Ҫ����Ͳ��ȡŨ��������Ϊ_______mL��
��2����ѧ������ȡŨ���ᣬ���ձ���ϡ�ͣ���ȴ�����º�ת�Ƶ�100mL����ƿ�У�ϴ�ӣ�Ȼ���ݣ�����ƿ�����������µߵ�ҡ�ȡ����ƹ����ж���õ�������������Ҫ������______________________��
��3����ʵ���н������в���ʹ������Һ�����ʵ���Ũ��ƫ�ߵ���_____________��
�ٶ���ʱ�۲�Һ�温�Ӣ�δ����ȴ���Ƚ���Һע������ƿ��
��ҡ�Ⱥ���Һ����ڿ̶����ټ�ˮ������ƿ��ԭ����������ˮ
��4����ѧ������100mL��Ͳ��ȡŨ���ᣬ��������С�ĵؼ�������ˮ��������ȣ�����ȴ�����º��ټ�ˮ��100mL�̶��ߣ�������ȣ�����Ϊ�˷��Ƿ���ȷ��������ȷ��ָ�����д���֮��__________________��
������֪������Ӧ���ɵ�I2�ɷ������·�Ӧ��I2��2S2O32����2I����S4O62����ijѧ���ⶨʳ�þ����εĵ⺬�����䲽��Ϊ��a.ȷ��ȡw gʳ�Σ�����������ˮʹ����ȫ�ܽ⣻b����ϡ�����ữ������Һ����������KI��Һ��ʹKIO3��KI��Ӧ��ȫ��c���Ե�����ҺΪָʾ������μ������ʵ���Ũ��Ϊ1.0��10-3mol/L ��Na2S2O3��Һ20.0 mL��ǡ�÷�Ӧ��ȫ��
��1��b�з�Ӧ��������I2�����ʵ�����________ mol��
��2����������ʵ��Ͱ�װ��˵�������⾫���εĵ⺬����_______________ mg/kg��(�Ժ�w�Ĵ���ʽ��ʾ)
���𰸡�20.0 ���裬�����٢ڲ�������Ͳϡ�ͣ����ܰ�ˮ����Ũ������1��10-5423/w
��������
I.��1������ϡ��ǰ���������ʵ�����ȣ���V(H2SO4)��10��3��18=100��10��3��3.6�����V(H2SO4)=20.0mL�������Ҫ����Ͳ��ȡ20.0mL��Ũ�����2��ϡ�����У��������������ǽ��裬��Һ�����У�����������������������3���ٶ���ʱ�����ӿ̶��ߣ�������Һ����ļ�С��Ũ��ƫ�ߣ��ʢ���ȷ����δ����ȴ��ע������ƿ����ȴ����Һ���ƫС��Ũ��ƫ�ߣ��ʢ���ȷ�����ټ�ˮ���൱��ϡ�ͣ�Ũ��ƫС���ʢ۴��ܶ�������ҺŨ����Ӱ�죬�ʢܴ���4����������Ͳ��ϡ��������ϡ��Ũ���ᣬӦ��Ũ������뵽ˮ�У��ӱ߽��裬��ͬѧ��������II.��1��b�в���I2�����ʵ���Ϊ20.0��10��3��1.0��10��3/2mol=1.0��10��5mol����2�����ݷ�Ӧ����ʽ�����Ĺ�ϵʽΪI��IO3����3I2��6S2O32����wgʳ���к�I�����ʵ���Ϊ20.0��10��3��1.0��10��3/6mol��������Ϊ2.0��10��5��127��103/6mg������Ϊ![]() =423/w��
=423/w��

 Ӧ������ҵ��ϵ�д�
Ӧ������ҵ��ϵ�д�����Ŀ�����ݱ���7�ֶ�����Ԫ�ص��й���Ϣ�жϣ�����˵���������![]() ����
����![]()
Ԫ�ر�� |
|
|
|
|
|
|
|
ԭ�Ӱ뾶 |
|
|
|
|
|
|
|
����ϼۻ���ͻ��ϼ� |
|
|
|
|
|
|
|
A. Ԫ��![]() ��̬�⻯����ȶ��Դ���Ԫ��
��̬�⻯����ȶ��Դ���Ԫ��![]() ��̬�⻯����ȶ���
��̬�⻯����ȶ���
B. Ԫ��![]() �⻯��ķе�С��Ԫ��
�⻯��ķе�С��Ԫ��![]() �⻯��ķе�
�⻯��ķе�
C. Ԫ��![]() �γɵĻ������������
�γɵĻ������������
D. ![]() ���γ����ӻ�����
���γ����ӻ�����