题目内容
用如图所示装置制取表格中的四种干燥、纯净的气体(必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是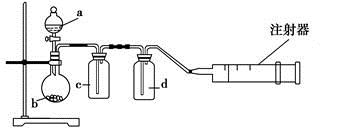
| 选项 | 气体 | a | b | c | d |
| A | SO2 | 浓硫酸 | Cu | H2O | 浓硫酸 |
| B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
| C | NH3 | 饱和NH4Cl溶液 | 消石灰 | 空集气瓶 | 固体NaOH |
| D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
D
解析

练习册系列答案
相关题目
将液体Y滴加到盛有固体X的试管中,并在试管口对生成的气体进行检验。下表中固体X、液体Y及检测方法对应关系有错误的是
| 选项 | 固体X | 液体Y | 检测方法 |
| A | CaO | 浓氨水 | 蘸有浓盐酸的玻璃棒 |
| B | Cu | 浓硫酸 | 沾有氯化钡溶液的玻璃片 |
| C | MnO2 | 双氧水 | 带火星的木条 |
| D | NaHCO3 | 醋酸溶液 | 沾有澄清石灰水的玻璃片 |
将过量的氯气通入30mL浓度为10.0mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3的共存体系。下列判断正确的是
| A.与NaOH反应的氯气一定为0.15 mol |
| B.当反应中被氧化的氯元素和被还原的氯元素之比为1:4时,溶液中NaClO和NaClO3的物质的量之比为3:1 |
| C.溶液中n(Na+):n(Cl-)可能为7:3 |
| D.若Cl2与NaOH的反应中转移的电子为n mol,则0.15<n<0.35 |
通过实验观察,某气体有下列性质:①有刺激性气味;②可使品红溶液褪色;③溶于水其水溶液可使石蕊试液变红;④通入浓硝酸中有红棕色气体产生;⑤可使溴水褪色。据此推测该气体可能是
| A.HCl | B.NH3 | C.Cl2 | D.SO2 |
(NH4)2SO4在一定条件下发生如下反应:4(NH4)2SO4 N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,将反应后的混合气体先通过置于冰水浴的U型管,再通入足量的BaCl2溶液,结果为
N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,将反应后的混合气体先通过置于冰水浴的U型管,再通入足量的BaCl2溶液,结果为
| A.产生BaSO4和BaSO3沉淀 | B.无沉淀产生 |
| C.产生BaSO4沉淀 | D.产生BaSO3沉淀 |
某硫酸厂废气厂SO2的回收利用方案如下图所示,下列说法不正确的是: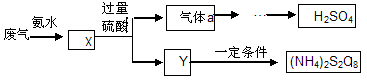
| A.X可能含有2种盐 | B.a是SO3 |
| C.Y可能含(NH4)2SO4 | D.(NH4)2S2O8中S元素的化合价不可能为+7 |
三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如下图所示。下列有关三硫化四磷说法中正确的是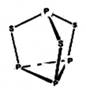
| A.该物质中磷元素的化合价为+3 |
B.该物质分子中含有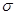 键和 键和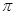 键 键 |
| C.该物质的熔、沸点比食盐高 |
| D.该物质22g含硫原子的数目约为1.806×1023 |
下列叙述中正确的是
| A.实验室制取氨气的发生装置与用高锰酸钾制取氧气的装置相同 |
| B.并不是所有的铵盐都能与烧碱共热生成氨气 |
| C.除去NO中混有的少量NO2,可将混合气体通过盛有水的洗气瓶,再用排空气法收集NO |
| D.CO2、NO2、P2O5均与水反应生成酸为酸性氧化物 |
对下列事实的解释正确的是( )。
| A.二氧化硫气体能用浓硫酸干燥,是因为二氧化硫无还原性 |
| B.医疗上可用硫酸钡作X射线透视肠胃的内服药,是因为硫酸钡不溶于酸 |
| C.向50 mL 18 mol·L-1的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45 mol |
| D.常温下,浓H2SO4可以用铝制容器贮存,说明铝与浓H2SO4不反应 |