题目内容
16.硼元素B在化学中有很重要的地位.硼的化合物在农业、医药、玻璃工业等方面用途很广.请回答下列问题:(1)写出与B元素同主族的Ga元素的基态原子核外电子排布简式1s22s22p63d104s24p1.从原子结构的角度分析,B、N、O元素的第一电离能由大到小的顺序为N>O>B.
(2)立方氮化硼可利用人工方法在高温高压条件下合成,属于超硬材料.同数原子晶体的氮化硼(BN)比晶体硅具有更高硬度和耐热性的原因是N原子和B原子的半径比硅原子小,B-N键长比Si-Si短.
(3)在BF3分子中中心原子的杂化轨道类型是sp2,SiF4微粒的空间构型是正四面体.又知若有d轨道参与杂化,能大大提高中心原子成键能力,试解释为什么BF3、SiF4水解的产物中,除了相应的酸外,前者生成BF4-,后者却是生成SiF${\;}_{6}^{2-}$:B原子最外电子层为L层,无d轨道;而Si原子最外层为N层,有d轨道,可参与杂化,使Si配位数增加至6.
分析 (1)镓是31号元素,其原子核外有31个电子,根据构造原理书写其基态原子核外电子排布式;同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素;
(2)原子晶体的硬度与原子半径、键长成反比;
(3)根据价层电子对互斥理论确定其杂化方式及空间构型;B原子最外电子层为L层,无d轨道;而Si原子最外层为N层,有d轨道.
解答 解:(1)镓位于周期表中第四周期第IIIA,故其核外电子排布式为1s22s22p63d104s24p1或[Ar]3d104s24p1;同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素,所以三种元素的第一电离能由大到小的顺序为N>O>B,
故答案为:1s22s22p63d104s24p1;N>O>B;
(2)原子晶体的硬度与原子半径、键长成反比,N原子和B原子的半径比硅原子小,B-N键长比Si-Si短键能大,所以氮化硼(BN)比晶体硅具有更高硬度和耐热性,
故答案为:N原子和B原子的半径比硅原子小,B-N键长比Si-Si短;
(3)在BF3分子中B原子的价层电子对等于3,且没有孤电子对,所以中心原子的杂化轨道类型是sp2杂化,SiF4中硅原子含有4个共价键,且不含孤电子对,中心原子的杂化轨道类型是sp3杂化,所以它的空间构型是正四面体型;B原子最外电子层为L层,无d轨道,而Si原子最外层为N层,有d轨道,可参与杂化,使Si配位数增加至6;
故答案为:sp2;正四面体;B原子最外电子层为L层,无d轨道;而Si原子最外层为N层,有d轨道,可参与杂化,使Si配位数增加至6.
点评 本题考查核外电子排布、电离能、杂化轨道等,注意同一周期中第一电离能的变化趋势及异常现象,为易错点,题目难度中等.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案| A. |  | B. |  | C. |  | D. |  |
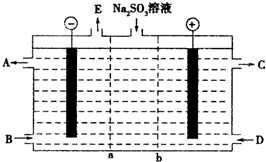 某研究小组用NaOH溶液吸收尾气中的二氧化硫,将所得的Na2SO3溶液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴阳膜组合循环再生机理如图所示,
某研究小组用NaOH溶液吸收尾气中的二氧化硫,将所得的Na2SO3溶液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴阳膜组合循环再生机理如图所示,