题目内容
8.简答题:(1)NH4Cl溶液呈酸性,用离子方程式表示原因NH4++H2O≒NH3.H2O+H+.
(2)普通泡沫灭火器的钢铁容器里装着一只小玻璃筒,其中玻璃筒内盛装Al2(SO4)3溶液,使用时,倒置灭火器,两种药液相混合就会喷出含二氧化碳的白色泡沫.产生此现象的离子方程式是Al3++3HCO3-=Al(OH)3↓+3CO2↑.
(3)NaHSO3溶液呈酸性性,原因HSO3-的电离程度大于水解程度.
(4)在25℃下,向浓度均为0.1mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成Cu(OH)2沉淀(填化学式),生成该沉淀的离子方程式为Cu2++2NH3•H2O=Cu(OH)2+2NH4+.
已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20.
分析 (1)NH4Cl为强酸弱碱盐,其溶液呈酸性;
(2)Al2(SO4)3水解显酸性,不能放在铁桶中;碳酸氢钠和硫酸铝溶液混合发生双水解反应生成氢氧化铝沉淀和二氧化碳气体;
(3)NaHSO3既水解又电离,以电离为主;
(4)难溶电解质的溶度积越小,加入氨水时越易生成沉淀.
解答 解;(1)NH4Cl为强酸弱碱盐,其溶液呈酸性,离子方程式为NH4++H2O?NH3•H2O+H+,
故答案为:酸性;NH4++H2O?NH3•H2O+H+;
(2)Al2(SO4)3水解显酸性,不能放在铁筒中,所以玻璃筒内盛装Al2(SO4)3;碳酸氢钠和硫酸铝溶液混合发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,反应的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
故答案为:Al2(SO4)3;Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(3)NaHSO3既水解又电离,HSO3-的电离程度大于水解程度,电离显酸性,所以溶液显酸性;
故答案为:酸性;HSO3-的电离程度大于水解程度;
(4)难溶电解质的溶度积越小,加入氨水时越易生成沉淀,则生成的沉淀为Cu(OH)2,反应的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,
故答案为:Cu(OH)2;Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+.
点评 本题考查盐类水解的分析判断、Ksp的计算,根据溶度积常数确定先沉淀的物质,溶度积常数越小的物质越先沉淀,铜离子和氨水反应生成氢氧化铜和铵根离子,掌握基础是关键,题目较简单..

练习册系列答案
相关题目
18.工业上常用铁质容器盛装冷浓硫酸.某兴趣小组的同学发现:将一定量的铁钉与浓硫酸加热时,观察到铁钉完全溶解,并产生大量气体.实验室现有下列试剂:0.01mol/L 酸性KMnO4溶液、0.10mol/L KI溶液、新制氯水、淀粉溶液、蒸馏水.请你协助他们探究所得溶液和气体的成分.
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中肯定含有SO2气体.
【实验探究】
【问题讨论】
(1)有同学提出:若另外选用KSCN溶液,则仅利用KSCN和新制氯水两种溶液即可完成猜想Ⅰ的所有探究,试问是否可行不正确(填:“正确”或“不正确”)并说明原因若溶液中含有Fe3+则无法检验溶液中是否含有Fe2+

(2)有同学提出:试管中气体可能是H2和Q气体,为此重新设计了实验装置如图1(图中夹持仪器省略).
①认为含有Q的理由是C+2H2SO4(浓硫酸)$\frac{\underline{\;\;△\;\;}}{\;}$CO2 ↑+2SO2↑+2H2O(用化学方程式表示).
②为确认Q的存在,则M中盛放的试剂为澄清的石灰水,并将装置M添加于C(选填序号).
a.A之前 b.A-B间 c.B-C间 d.C-D间
③装置图2中D、E、F组合的作用是确认是否有H2.
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中肯定含有SO2气体.
【实验探究】
| 实验操作 | 预期现象 | 结 论 | |
| 验证猜想Ⅰ | 步骤①:取少量0.01mol/L 酸性KMnO4溶液,滴入所得溶液中 | 溶液紫红色褪去 | 含有Fe2+ |
| 步骤②:另取少量所得溶液,滴加KI溶液和淀粉溶液 | 溶液变为蓝色 | 含有Fe3+ | |
| 验证猜想Ⅱ | 将所得气体通入如下装置 | 甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变,试管中收集到气体 | 含有两种或以上气体 |
(1)有同学提出:若另外选用KSCN溶液,则仅利用KSCN和新制氯水两种溶液即可完成猜想Ⅰ的所有探究,试问是否可行不正确(填:“正确”或“不正确”)并说明原因若溶液中含有Fe3+则无法检验溶液中是否含有Fe2+

(2)有同学提出:试管中气体可能是H2和Q气体,为此重新设计了实验装置如图1(图中夹持仪器省略).
①认为含有Q的理由是C+2H2SO4(浓硫酸)$\frac{\underline{\;\;△\;\;}}{\;}$CO2 ↑+2SO2↑+2H2O(用化学方程式表示).
②为确认Q的存在,则M中盛放的试剂为澄清的石灰水,并将装置M添加于C(选填序号).
a.A之前 b.A-B间 c.B-C间 d.C-D间
③装置图2中D、E、F组合的作用是确认是否有H2.
3.现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是BD.
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)•c(OH-) D.c(OH-)/c(H+)
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡向右(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将减小(填“增大”、“减小”或“无法确定”).
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)< V(乙)( 填“>”、“<”或“=”).
(4)已知25℃时,两种酸的电离平衡常数如下:
下列四种离子结合H+能力最强的是B.
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(5)常温下,取甲溶液稀释100倍,其pH=4;取99mL甲溶液与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=10.
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是BD.
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)•c(OH-) D.c(OH-)/c(H+)
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡向右(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将减小(填“增大”、“减小”或“无法确定”).
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)< V(乙)( 填“>”、“<”或“=”).
(4)已知25℃时,两种酸的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3.0×10-8 |
| K2 | -- | 5.6×10-11 | -- |
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(5)常温下,取甲溶液稀释100倍,其pH=4;取99mL甲溶液与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=10.
13.已知NaHSO3溶液显酸性,则NaHSO3溶液中微粒浓度关系不正确的是( )
| A. | c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | B. | c(Na+)=2c(SO32-)+c(HSO3-) | ||
| C. | c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) | D. | c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-) |
17.金属的腐蚀除化学腐蚀和普通的电化学腐蚀外,还有“氧浓差腐蚀”,如在管道或缝隙等处的不同部位氧的浓度不同,在氧浓度低的部位是原电池的负极.下列说法正确的是( )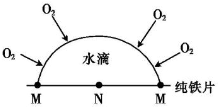

| A. | 纯铁的腐蚀属于电化学腐蚀 | |
| B. | 钢铁吸氧腐蚀时,负极的电极反应式为Fe-3e-═Fe3﹢ | |
| C. | 海轮在浸水部位镶一些铜锭可起到抗腐蚀作用 | |
| D. | 在图示氧浓差腐蚀中,M极处发生的电极反应为O2+2H2O+4e-═4OH- |
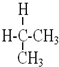 与
与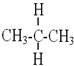 互为同分异构体
互为同分异构体 与
与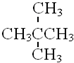 属于同系物
属于同系物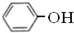 与
与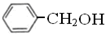 既不是同系物也不是同分异构体.
既不是同系物也不是同分异构体.