题目内容
【题目】设NA为阿伏加德罗常数的值。下列说法中正确的是
A.28 g乙烯所含的共用电子对数目为2NA
B.133.5 g AlCl3晶体含有的粒子数目为4NA
C.0.1 mol Cl2与足量石灰乳反应,转移电子的数目为0.2NA
D.将0.2 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH![]() 的数目为0.2NA
的数目为0.2NA
【答案】D
【解析】
A. 1个乙烯分子含有6对共用电子对,28 g乙烯的物质的量为1 mol,则所含的共用电子对数目为6NA,故A错误;
B. 粒子指代不明,无法确定个数,故B错误;
C. Cl2与足量石灰乳反应生成氯化钙、次氯酸钙,所以0.1 mol Cl2与足量石灰乳反应,转移电子的数目为0.1NA,故C错误;
D. 将0.2 mol NH4NO3溶于稀氨水,根据电荷守恒可知:N(NH4+)+N(H+)=N(NO3-)+N(OH-),溶液呈中性,即N(H+)=N(OH-),则N(NH4+)=N(NO3-)=0.2 mol ,故溶液中NH4+的数目为0.2NA,故D正确。
综上所述,答案为D。

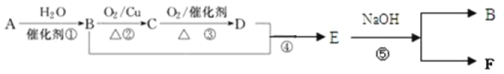
【题目】由碳酸锰矿(主要成分MnCO3,还含有FeCO3、MnO2、Al2O3、SiO2等)中提取金属锰的一种流程如下:

(1) “酸浸”过程中,提高锰元素浸出率的措施有:适当提高酸的浓度、________________(填一种)。
(2) 保持其他条件不变,在不同温度下对碳酸锰矿进行酸浸,锰元素的浸出率随时间变化如下图所示,则酸浸的最佳温度和时间分别是________。

提取过程中相关金属离子生成氢氧化物沉淀的pH
金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
开始沉淀的pH | 1.8 | 5.8 | 3.0 | 7.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.8 |
(3) 已知“酸浸”后溶液中锰元素只以Mn2+形式存在,则“酸浸”中发生氧化还原反应的离子方程式为________________________________________。
(4) 结合上表,“除铁、铝”时加入氨水控制反应液pH的范围为________。
(5) 若上述流程中加入的H2O2不足量,则待电解溶液中会有铁元素残余,进而会影响最终锰的纯度。请设计简要实验方案加以验证待电解溶液中是否含有铁元素: _________________。
(6) 以石墨为电极电解除铁、铝后的溶液获得单质锰。电解废液中可循环利用的溶质是________。
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
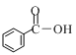
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,各原子均满足8电子稳定结构。其电子式是__________________。氯碱工业生产时,由于食盐水中通常含有少量NH4Cl,而在阳极区与生成的氯气反应产生少量NCl3,该反应的化学方程式为_____________。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0mol/LNaOH溶液充分反应放出的热量如下表所示:
反应序号 | n (CO2)/mol | V (NaOH) /L | 放出的热量/kJ |
1 | 0.5 | 0.75 | a |
2 | 1.0 | 2.00 | b |
该条件CO2与NaOH 溶液反应生成NaHCO3的热化学反应方程式为______________________。
(3)利用CO可以将NO转化为无害的N2,其反应为: 2NO(g) +2CO(g) ![]() N2(g) +2CO2(g),向容积均为1L的甲、乙两个恒温(温度分别为300℃、T℃)容器中分别加入2.00molNO和2.00molCO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g) +2CO2(g),向容积均为1L的甲、乙两个恒温(温度分别为300℃、T℃)容器中分别加入2.00molNO和2.00molCO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
N甲(CO)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
N乙(CO)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
/p>
①甲容器中,0~40min 内用NO的浓度变化表示的反应速率v(NO)=_____________。
②该反应的△H____0(填“>”或“<”)。
③甲容器反应达到平衡后,若容器内各物质的量均增加1倍,则平衡______(填“正向”、“逆向”或“不”)移动。
(4)常温下, 在(NH4)2C2O4溶液中,反应NH4++C2O42-+H2O![]() NH3·H2O+HC2O4-的平衡常数K=________________________。(已知常温下,NH3·H2O的电离平衡常数Kb=2×10-5,H2C2O4的电离平衡常数Ka1=5×10-2,Ka2=5×10-5)
NH3·H2O+HC2O4-的平衡常数K=________________________。(已知常温下,NH3·H2O的电离平衡常数Kb=2×10-5,H2C2O4的电离平衡常数Ka1=5×10-2,Ka2=5×10-5)
(5)在酸性电解质溶液中,以惰性材料作电极,将CO2转化为丙烯的原理如下图所示
①太阳能电池的负极是__________(填“a”或“b”)
②生成丙烯的电极反应式是_____________________________。