题目内容
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料.由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:
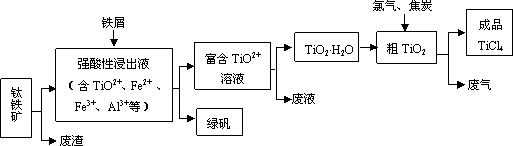
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性.该过程中有如下反应发生:2Fe3++Fe![]() 3Fe2+
3Fe2+
2TiO2+(无色)+Fe+4H+![]() 2Ti3+(紫色)+Fe2++2H2O
2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O![]() TiO2+(无色)+Fe2++2H+
TiO2+(无色)+Fe2++2H+
加入铁屑的作用是________.
(2)在②→③工艺中需要控制条件以形成TiO2·nH2O溶胶,该分散质颗粒直径大小在________范围.
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉.已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+Fe3++H2O的平衡常数K=________.
(4)已知:TiO2(s)+2Cl2(g)![]() TiCl4(l)+O2(g)ΔH=+140 KJ·mol-1
TiCl4(l)+O2(g)ΔH=+140 KJ·mol-1
2C(s)+O2(g)![]() 2CO(g) ΔH=-221 KJ·mol-1
2CO(g) ΔH=-221 KJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:________.
(5)上述工艺具有成本低、可用低品位矿物为原料等优点.依据绿色化学理念,该工艺流程中存在的不足之处是________(只要求写出一项).
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用________方法.
![]()

|
工业上常用金属钠来提炼钛、锆等.已知在700℃-800℃时,钠可从四氯化钛(TiCl4)中还原出钛,则用此法制取96 g钛时需要钠的理论质量为 | |
| [ ] | |
A. |
11.5 g |
B. |
23 g |
C. |
184 g |
D. |
92 g |
| |||||||||||||||||||||||


 Fe3++3H2O的平衡常数K=
。
Fe3++3H2O的平衡常数K=
。