题目内容
下列各溶液中,有关成分的物质的量浓度关系正确的是 ( )
A.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:c(Cl-)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
D.pH相等的(NH4)2SO4、 (NH4)2Fe (SO4)2、NH4Cl溶液:c(NH4Cl)<c[(NH4)2Fe (SO4)2]< c[(NH4)2SO4]
C
解析试题分析:10mL0.5mol·L-1CH3COONa溶液与6mLlmol·L-1盐酸混合,发生反应,相对于溶液中CH3COOH、NaCl、HCl的物质的量浓度之比为5:5:1,所以c(Cl-)>c(Na+),溶液呈酸性,c(H+)>c(OH-),醋酸是弱酸,发生电离,电离程度不大,所以c(Na+)>c(CH3COO-),c(H+)>c(CH3COO-),故为c(Cl-)>c(Na+)>c(H+)>c(CH3COO-)>c(OH-),故A错误;0.1mol·L-1的NaHB溶液pH为4,说明HB-为弱酸根,且HB-电离程度大于其水解程度,电离生成B2-,水解生成H2B,所以c(B2-)>c(H2B),电离与水解程度不大,c(HB-)最大,所以c(HB-)>c(B2-)>c(H2B),故B错误;硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性,铵根离子有剩余,溶液为硫酸钠、硫酸铵、氨水的混合溶液,加入的氢氧化钠的物质的量大于硫酸氢铵,所以c(Na+)>c(SO42-),根据物料守恒,n(SO42-)=n(NH4+)+n(NH3·H2O),所以c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故C正确;相同pH的(NH4)2SO4与NH4Cl溶液中,硫酸铵和氯化铵都是强酸弱碱盐,根据溶液呈电中性可判断二者NH4+浓度相等,即2c[(NH4)2SO4]=c(NH4Cl),亚铁离子抑制铵根离子水解,所以pH相等的(NH4)2SO4溶液, (NH4)2Fe (SO4)2溶液和NH4Cl溶液:c[(NH4)2SO44]<c(NH4Cl)<c[ (NH4)2Fe (SO4)2],故D错误;故选C。
考点:考查离子浓度大小的比较。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案少量二氧化碳通入NaCN溶液中,发生如下反应:CO2 + H2O + CN- =HCO3- + HCN。以下说法正确的是(温度均为25℃)
| A.电离常数:K(HCN) <Ka2 (H2CO3) |
| B.浓度均为0.1mol·L-1的NaCN和NaHCO3溶液的pH:NaCN <NaHCO3 |
| C.浓度均为0.1mol·L-1的NaCN和Na2CO3溶液中,阴离子总浓度相等 |
| D.pH均为10的 Na2CO3溶液、NaCN溶液中,水电离产生的c(OH-)相等 |
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3
主要:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
次要:Cu2++CO32-=CuCO3↓(几乎不发生反应。下同)
(2)CuSO4+Na2S
主要:Cu2++S2-=CuS↓
次要:Cu2++S2-+2H2O=Cu(OH)2↓+H2S↑
则下列几种物质的溶解度大小的比较中,正确的是( )
| A.CuS<Cu(OH)2<CuCO3 |
| B.CuS>Cu(OH)2>CuCO3 |
| C.Cu(OH)2>CuCO3>CuS |
| D.Cu(OH)2<CuCO3<CuS |
下列叙述正确的是( )
| A.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其c(H+)·c(OH-)=1×10-14 |
| B.c(H+)=1×10-7mol·L-1的溶液一定是中性溶液 |
| C.0.2 mol·L-1CH3COOH溶液中的c(H+)是0.1 mol·L-1CH3COOH溶液中的c(H+)的2倍 |
| D.任何浓度的溶液都可以用pH来表示其酸性的强弱 |
在常温下,0.100 0 mol·L-1 Na2CO3溶液25 mL用0.100 0 mol·L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )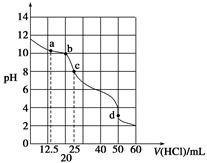
| A.a点:c(CO32-)=c(HCO3-)>c(OH-) |
| B.b点:5c(Cl-)>4c(HCO3-)+4c(CO32-) |
| C.c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| D.d点:c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
常温下,向100 mL 0.1 mol·L-1 H2A(二元酸)溶液中逐滴加入0.2 mol·L-1 NaOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。下列有关说法正确的是( )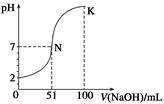
| A.H2A为二元强酸 |
| B.N点对应溶液有:c(Na+)=c(A2-)+c(HA-) |
| C.K点对应溶液中离子浓度由大到小的顺序为c(A2-)>c(Na+)>c(OH-)>c(H+) |
| D.K点时加水稀释溶液,c(H+)增大 |
下列关于电解质溶液的叙述正确的是( )
| A.常温下,在pH=7的醋酸钠和醋酸混合溶液中:c(CH3COO-)>c(Na+) |
| B.稀释醋酸溶液,溶液中所有离子的浓度均降低 |
| C.在pH=5的氯化钠和稀硝酸的混合溶液中,c(Na+)=c(Cl-) |
| D.0.1 mol·L-1的硫化钠溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
用水稀释0.1 mol·L-1氨水时,溶液中随水量的增加而减小的是 ( )。
| A.c(OH-)/c(NH3·H2O) |
| B.c(NH3·H2O)/c(OH-) |
| C.n(OH-)和c(H+) |
| D.c(H+)和c(OH-)的乘积 |

 H+ + HA-;HA—
H+ + HA-;HA—  H+ + A2-
H+ + A2-