题目内容
少量二氧化碳通入NaCN溶液中,发生如下反应:CO2 + H2O + CN- =HCO3- + HCN。以下说法正确的是(温度均为25℃)
| A.电离常数:K(HCN) <Ka2 (H2CO3) |
| B.浓度均为0.1mol·L-1的NaCN和NaHCO3溶液的pH:NaCN <NaHCO3 |
| C.浓度均为0.1mol·L-1的NaCN和Na2CO3溶液中,阴离子总浓度相等 |
| D.pH均为10的 Na2CO3溶液、NaCN溶液中,水电离产生的c(OH-)相等 |
D
解析试题分析:根据强酸制取弱酸的反应原理。少量二氧化碳通入NaCN溶液中,发生如下反应:CO2 + H2O + CN- =HCO3- + HCN。则酸性H2CO3>HCN> HCO3-。A.在相同的温度下电离平衡常数就越大,溶液的酸性越强。电离常数:K(HCN) > Ka2 (H2CO3).错误。B.对于弱酸来说,酸性越强,其水解的程度就越小。由于酸性:H2CO3>HCN。所以浓度均为0.1mol·L-1的NaCN和NaHCO3溶液的pH:NaCN > NaHCO3。错误。C.在溶液中会发生水解反应。H2O + CN- HCN+OH-.CO32- +H2O
HCN+OH-.CO32- +H2O HCO3-+OH-;HCO3-+H2O
HCO3-+OH-;HCO3-+H2O H2CO3+OH-由于CO32-水解的程度大,产生的都是阴离子,而CN-水解的程度小。水解消耗的阴离子与产生的阴离子数目相等。所以阴离子总浓度Na2CO3溶液大。错误。D.Na2CO3和NaCN都是盐,水解使溶液显碱性。若溶液的pH相等,则水电离产生的c(OH-)相等。正确。
H2CO3+OH-由于CO32-水解的程度大,产生的都是阴离子,而CN-水解的程度小。水解消耗的阴离子与产生的阴离子数目相等。所以阴离子总浓度Na2CO3溶液大。错误。D.Na2CO3和NaCN都是盐,水解使溶液显碱性。若溶液的pH相等,则水电离产生的c(OH-)相等。正确。
考点:考查盐水解的规律及离子浓度的大小比较、与弱酸的电离平衡常数的关系的知识。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案下列叙述或表示正确的是
| A.0.1 mol·L-1的醋酸的pH=a,0.01 mol·L-1的醋酸的pH=b,则a+1=b |
| B.常温下0.1 mol·L-1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COOˉ)="0.1" mol·L-1 |
| C.难溶电解质AB2的饱和溶液中,c(A2+)=xmol·L-1, c(B-)="y" mol·L-1,则Ksp值为4xy2 |
| D.用200mL4 mol·L-1的NaOH溶液将0.6mol CO2完全吸收,反应的离子方程式为:3CO2+4OHˉ=CO32ˉ+2HCO3ˉ+H2O |
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。已知: pX=-lgc(X)。下列说法正确的是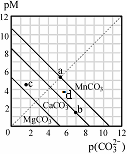
| A.在该温度下,MgCO3、MnCO3的溶解度依次增大 |
| B.d点可表示MnCO3的过饱和溶液,且c(Mn2+)>c(CO32-) |
| C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) |
| D.c点可表示MgCO3的不饱和溶液,且c(Mg2+)>c(CO32-) |
在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-离子浓度分别为A mol·L-1与B mol·L-1,则A和B的关系为
| A.A>B | B.A=10-4B | C.B=10-4A | D.A=B |
对室温下氢离子浓度、体积均相同的HCl溶液和CH3COOH溶液分别采取以下措施,
有关叙述正确的是( )
| A.加适量的CH3COONa晶体,两溶液的氢离子浓度减小 |
| B.使温度升高20 ℃,两溶液的氢离子浓度不变 |
| C.加水稀释2倍,两溶液的氢离子浓度增大 |
| D.加足量的Zn充分反应后,两溶液中产生的氢气一样多 |
在25 ℃时,将0.2 mol CH3COONa晶体和0.1 mol HCl气体同时溶解于同一烧杯的水中,制得1 L溶液,若此溶液中c(CH3COO-)>c(Cl-),则下列判断不正确的是( )
| A.该溶液的pH小于7 |
| B.c(CH3COOH)+c(CH3COO-)=0.20 mol·L-1 |
| C.c(CH3COOH)<c(CH3COO-) |
| D.c(CH3COO-)+c(OH-)=0.10 mol·L-1 |
在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2 Mg2++2OH-,要使Mg(OH)2固体减少而c(Mg2+)不变,可采取的措施是 ( )
Mg2++2OH-,要使Mg(OH)2固体减少而c(Mg2+)不变,可采取的措施是 ( )
| A.加MgSO4 | B.加HCl溶液 | C.加NaOH | D.加少量水 |
25°C时,弱酸的电离平衡常数如下表:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10-5 | 4.9×10-10 | K1:4.3×10-7 K2:5.6×10-11 |
下列有关说法正确的是( )
A.等物质的量浓度的各溶液的pH关系为:
pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1HCN与b mol·L-1 NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则a一定小于b
C.往冰醋酸中逐滴加水,溶液导电能力增大
D.NaHCO3和Na2CO3的混合液中:c(Na+)+c(H+)=c(OH-)+c(HCO3—)+2c(CO32—)