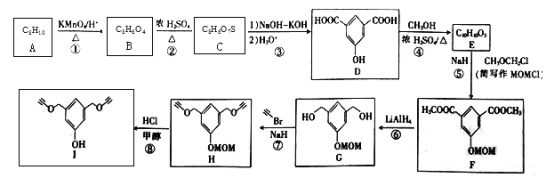
题目内容
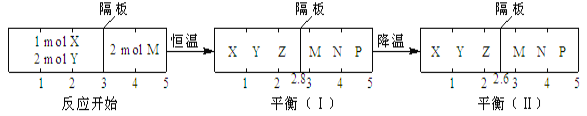
【题目】向2L密闭容器中通入amol气体A,在一定条件下发生反应:xA(g)![]() yB(g)+pC(g)+qD(g)。已知:平均反应速率
yB(g)+pC(g)+qD(g)。已知:平均反应速率![]() ;反应至2min时,A的物质的量减少为起始时的
;反应至2min时,A的物质的量减少为起始时的![]() ,生成B、D的物质的量分別为
,生成B、D的物质的量分別为![]() a mol、a mol。回答下列问题:
a mol、a mol。回答下列问题:
(1)0~2min内,![]() __________________。
__________________。
(2)该反应的化学方程式为_________________________________________。
(3)反应xA(g)![]() yB(g)+pC(g)+qD(g)达到化学平衡状态的标志是________(填序号)。
yB(g)+pC(g)+qD(g)达到化学平衡状态的标志是________(填序号)。
①A(g)的消耗速率与C(g)的生成速率之比为x:p
②A(g)的物质的量保持恒定
③A(g)的消耗速率与D(g)的消耗速率之比为q:x
④B(g)和C(g)的物质的量之比为y:p
(4)若A、B的起始浓度分别为m mol/L、n mol/L(C、D的起始浓度均为0),反应达到平衡时,A、B的浓度分别为0.5 mol/L、0.1 mol/L,则m、n应满足的关系为__________(用含m、n的等式表示)。
【答案】1/12a mol/(L.min) 2A(g)![]() 3B(g)+C(g)+6D(g) ② 1.5m+n=0.85
3B(g)+C(g)+6D(g) ② 1.5m+n=0.85
【解析】
已知平均反应速率![]() ,则x=2p;反应至2min时,A的物质的量减少为起始时的
,则x=2p;反应至2min时,A的物质的量减少为起始时的![]() ,即消耗A是a/3mol,生成B、D的物质的量分別为
,即消耗A是a/3mol,生成B、D的物质的量分別为![]() a mol、a mol,所以x:y:q=1/3:1/2:1=2:3:6。则x:y:p:q=2:3:1;1:6。据此判断。
a mol、a mol,所以x:y:q=1/3:1/2:1=2:3:6。则x:y:p:q=2:3:1;1:6。据此判断。
(1)0~2min内消耗A的浓度是a/6 mol·L-1,则![]() a/6 mol·L-1÷2min=1/12a mol/(L·min)。
a/6 mol·L-1÷2min=1/12a mol/(L·min)。
(2)根据以上分析可知该反应的化学方程式为2A(g)![]() 3B(g)+C(g)+6D(g)。
3B(g)+C(g)+6D(g)。
(3)①A(g)的消耗速率与C(g)的生成速率之比为x:p均表示正反应速率,不一定达到平衡状态;
②A(g)的物质的量保持恒定说明正逆反应速率相等,达到了平衡状态;
③A(g)的消耗速率与D(g)的消耗速率之比为q:x不满足正逆反应速率相等,没有达到平衡状态;
④B(g)和C(g)的物质的量之比为y:p不能说明正逆反应速率相等,不一定达到平衡状态;
答案选②;
(4)若A、B的起始浓度分别为m mol/L、n mol/L(C、D的起始浓度均为0),反应达到平衡时,A、B的浓度分别为0.5 mol/L、0.1 mol/L,则根据变化量之比是化学计量数之比可知(0.5-m):(n-0.1)=2:3,解得1.5m+n=0.85。