题目内容
(1)写出实验室制备氯气的化学方程式:
(2)工业上可用氯气制备漂白粉,请写出制备漂白粉的化学方程式:
(3)某学生用含0.4molHCl的浓盐酸和足量的MnO2反应制Cl2,但得到的Cl2总小于2.24L(标准状况下),原因是:
MnO2+4HCl
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl
MnCl2+Cl2↑+2H2O
.
| ||
(2)工业上可用氯气制备漂白粉,请写出制备漂白粉的化学方程式:
2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O
2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O
.(3)某学生用含0.4molHCl的浓盐酸和足量的MnO2反应制Cl2,但得到的Cl2总小于2.24L(标准状况下),原因是:
浓盐酸随反应进行浓度减小,变为稀盐酸后不能和二氧化锰反应生成氯气,所以实际生成氯气小于2,24L
浓盐酸随反应进行浓度减小,变为稀盐酸后不能和二氧化锰反应生成氯气,所以实际生成氯气小于2,24L
.分析:(1)实验室利用二氧化锰做氧化剂和还原剂浓盐酸加热反应生成二氧化锰、氯气和水;
(2)工业上利用消石灰和氯气反应生成氯化钙、次氯酸钙和水的反应制备漂白粉;
(3)浓盐酸随反应进行浓度减小,变为稀盐酸后不能和二氧化锰反应生成氯气.
(2)工业上利用消石灰和氯气反应生成氯化钙、次氯酸钙和水的反应制备漂白粉;
(3)浓盐酸随反应进行浓度减小,变为稀盐酸后不能和二氧化锰反应生成氯气.
解答:解:(1)实验室利用二氧化锰做氧化剂和还原剂浓盐酸加热反应生成二氧化锰、氯气和水,反应的化学方程式为MnO2+4HCl
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl
MnCl2+Cl2↑+2H2O;
(2)工业上利用消石灰和氯气反应生成氯化钙、次氯酸钙和水的反应制备漂白粉,反应的化学方程式为2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O;
(3)0.4molHCl的浓盐酸和足量的MnO2反应制Cl2,浓盐酸随反应进行浓度减小,变为稀盐酸后不能和二氧化锰反应生成氯气,得到的Cl2物质的量小于0.1mol,体积总小于2.24L(标准状况下),故答案为:浓盐酸随反应进行浓度减小,变为稀盐酸后不能和二氧化锰反应生成氯气,所以实际生成氯气小于2,24L.
| ||
故答案为:MnO2+4HCl
| ||
(2)工业上利用消石灰和氯气反应生成氯化钙、次氯酸钙和水的反应制备漂白粉,反应的化学方程式为2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O;
(3)0.4molHCl的浓盐酸和足量的MnO2反应制Cl2,浓盐酸随反应进行浓度减小,变为稀盐酸后不能和二氧化锰反应生成氯气,得到的Cl2物质的量小于0.1mol,体积总小于2.24L(标准状况下),故答案为:浓盐酸随反应进行浓度减小,变为稀盐酸后不能和二氧化锰反应生成氯气,所以实际生成氯气小于2,24L.
点评:本题考查了实验室制备氯气及其定量计算分析、漂白粉的制备,主要是氯气性质的应用,题目较简单.

练习册系列答案
相关题目

 CH2=CHCl
CH2=CHCl
 在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计如图实验以确认上述混合气体中有C2H4和SO2.
在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计如图实验以确认上述混合气体中有C2H4和SO2.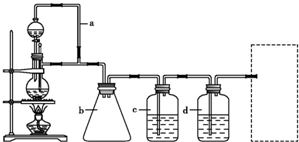 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH3CH-CH2+CO+H2
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH3CH-CH2+CO+H2
 丁醇,查阅资料得知一条合成路线:
丁醇,查阅资料得知一条合成路线: CH2+CO+H2
CH2+CO+H2 CH3CH2CH2CHO
CH3CH2CH2CHO CH3CH2CH2CH2OH;CO的制备原理:HCOOH
CH3CH2CH2CH2OH;CO的制备原理:HCOOH CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。
