题目内容
【题目】铝热反应是铝的一个重要性质。
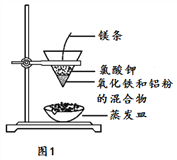
(1)按如图装置进行实验,可观察到反应剧烈,火星四射,漏斗下方有红热熔融物“铁块”流出。
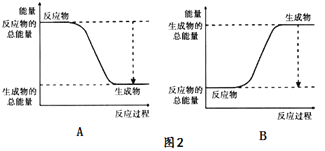
该反应的化学方程式为_____,其能量变化为如图中的______(填“A”或“B”)所示。
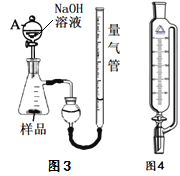
(2)某校化学兴趣小组同学,为了测定铝热反应后得到“铁块”混合物中铝的含量。取“铁块”样品研碎称得质量为x g,加入如图装置,再滴入足量NaOH溶液充分反应,测量生成气体体积为a ml(标况)。
①仪器A的名称为_______。
②写出样品中Al与NaOH反应的化学方程式_______。
③该小组同学改进实验,用恒压漏斗(如图)代替仪器A,其优点有________(写2点)。
④该样品中铝的含量为_________。
【答案】 2Al+Fe2O3 ![]() Al2O3+2Fe A 分液漏斗 2Al+2OH+6H2O=2[Al(OH)4]+3H2 让液体顺利滴入锥形瓶;降低液体体积对气体体积造成偏大的误差 9a/11200x
Al2O3+2Fe A 分液漏斗 2Al+2OH+6H2O=2[Al(OH)4]+3H2 让液体顺利滴入锥形瓶;降低液体体积对气体体积造成偏大的误差 9a/11200x
【解析】(1)Al还原Fe2O3生成Fe和Al2O3,配平可得化学方程式:2Al+Fe2O3![]() Al2O3+2Fe。该反应是放热反应,其能量变化为如图中的A所示。(2)①仪器A是是分液漏斗;②铝和氢氧化钠溶液反应的离子方程式为2Al+2OH+6H2O=2[Al(OH)4]+3H2↑;③恒压漏斗的作用是让液体顺利滴入锥形瓶,同时降低液体体积对气体体积造成偏大的误差;④氢气物质的量是
Al2O3+2Fe。该反应是放热反应,其能量变化为如图中的A所示。(2)①仪器A是是分液漏斗;②铝和氢氧化钠溶液反应的离子方程式为2Al+2OH+6H2O=2[Al(OH)4]+3H2↑;③恒压漏斗的作用是让液体顺利滴入锥形瓶,同时降低液体体积对气体体积造成偏大的误差;④氢气物质的量是![]() ,根据方程式可知消耗铝是
,根据方程式可知消耗铝是![]() ,因此该样品中铝的含量为
,因此该样品中铝的含量为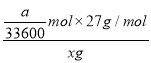 =9a/11200x。
=9a/11200x。

练习册系列答案
相关题目