题目内容
工业上合成氨的化学反应N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
ΔH=-92.4 KJ·mol-1、ΔS=-198.3 J·mol-1·K-1,且ΔG=ΔH-T ΔS.在容积为10 L的密闭容器中,通入40 mol N2和120 mol H2在一定条件下进行反应,4 S后达到平衡状态,此时N2的浓度为2 mol/L.通过计算回答下列问题:
(1)在温度为298K时,该反应________(填“能”或“不能”)自发进行.反应进行到平衡状态时ΔG=________.
(2)用N2表示的4S内化学反应的平均速率是________.
(3)在该条件下N2的最大转化率是________;此时混合气体中NH3的体积分数是________.
(4)为了提高氨气的产率,可以选择的方法是________(填序号,错选扣分).
①升高温度
②增大压强
③使用催化剂
④及时分离出NH3
解析:
(1)能 0(2分)
(2)0.5 mol·L-1·S-1(1分)
(3)50%(1分) 33.3%(2分)
(4)②④(2分)

氨气是生产氮肥、硝酸、纯碱等的重要原料。
(1)实验室模拟合成氨。在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料(单位是mol /L),平衡时测得甲容器中H2的转化率为20%。
|
|
N2 |
H2 |
NH3 |
|
甲 |
1 |
3 |
0 |
|
乙 |
0.5 |
1.5 |
1 |
|
丙 |
0 |
0 |
4 |
①平衡时甲容器中氨气的浓度为 。
②乙容器中开始反应时,v逆 v正(填<、>或=)。
③达平衡时,甲、乙、丙三容器中NH3的体积分数由大到小的顺序为 。
(2)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:
2NH3 (g)+ CO2 (g) 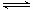 CO(NH2)2
(l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2
(l) + H2O (l),该反应的平衡常数和温度关系如下:
|
T / ℃ |
165 |
175 |
185 |
195 |
|
K |
111.9 |
74.1 |
50.6 |
34.8 |
①焓变ΔH_____0(填“>”、“<”或“=”)。
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比) =x,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
=x,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。

③右图中的B点处,NH3的平衡转化率为 。


 [Cu(NH3)3]Ac•CO(aq)(△H<0)
[Cu(NH3)3]Ac•CO(aq)(△H<0)

 2NH3,
2NH3,