题目内容
14.指常温下,1mol化学键分解成气态原子所需要的能量用E表示.结合下表信息判断不正确的是( )| 共价键 | H-H | F-F | H-F | H-Cl | H-I |
| E(kJ•mol -1 ) | 436 | 157 | 568 | 432 | 298[ |
| A. | H2(g)+F2(g)═2HF(g)△H=-25 kJ•mol -1 | |
| B. | 表中最稳定的共价键是H-F键 | |
| C. | H 2(g)→2H(g)△H=+436 kJ•mol -1 | |
| D. | 432 kJ•mol -1>E(H-Br)>298 kJ•mol -1 |
分析 A.反应焓变=反应物键能总和-生成物键能总和;
B.键能越大形成的化学键越稳定;
C.氢气变化为氢原子吸热等于氢气中断裂化学键需要的能量;
D.溴原子半径大于氯原子小于碘原子,半径越大键能越小.
解答 解:A.反应焓变=反应物键能总和-生成物键能总和,△H=436KJ/mol+157KJ/mol-2×568KJ/mol=-543KJ/mol,H2(g)+F2(g)=2HF(g)△H=-543 kJ•mol-1,故A错误;
B.键能越大形成的化学键越稳定,表中键能最大的是H-F,最稳定的共价键是H-F键,故B正确;
C.氢气变化为氢原子吸热等于氢气中断裂化学键需要的能量,H2(g)→2H (g)?△H=+436 kJ•mol-1 ,故C正确;
D.溴原子半径大于氯原子小于碘原子,半径越大键能越小,所以结合图表中数据可知432 kJ•mol-1>E(H-Br)>298 kJ•mol-1,故D正确;
故选A.
点评 本题考查了化学反应能量变化和键能的关系分析判断,焓变计算方法是解题关键,题目难度中等.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
5.下列有关氢化物的叙述中正确的是( )
| A. | 稳定性:H2S>HF | B. | HCl的电子式为 | ||
| C. | H2O的摩尔质量为18 | D. | 在卤化氢中HI最稳定 |
2.现有浓度为1mol/L的五种溶液:①H2SO4,②HCl,③CH3COOH,④NH4Cl,⑤NaOH,⑥Ba(OH)2由水电离出的c(H+)大小关系正确的是( )
| A. | ①=②>③>④>⑤>⑥ | B. | ④>③>②=⑤>①=⑥ | C. | ①=⑥>②>③>④>⑤ | D. | ④>③>②>⑤>①>⑥ |
9.下列说法正确的是( )
| A. | 1 L水中溶解1 mol NaCl所形成溶液的物质的量浓度为1 mol•L-1 | |
| B. | 标准状况下,22.4 L HCl溶于1 L水中形成的溶液体积为1 L | |
| C. | 标准状况下,将33.6 L HCl溶于水形成1 L溶液,其物质的量浓度是1.5 mol•L-1 | |
| D. | 1 mol CaCl2溶于水形成1 L溶液,所得溶液中c(Cl-)等于1 mol•L-1 |
19.设NA表示阿伏加得德罗常数的数值,下列叙述中正确的是( )
| A. | 0.2 mol/L的Ba(NO3)2溶液1 L,含NO3-数为0.2NA | |
| B. | 常温常压下,22.4L氧气所含的原子数为2NA | |
| C. | 常温常压下,48gO2、O3组成的混合气体所含的氧原子数为3NA | |
| D. | 1L0.1 mol/LNaCl溶液中所含的Na+ 的电子数为1.1NA |
6.下列情况不能用胶体知识加以解释的是( )
| A. | 氯化铝溶液中加入小苏打溶液会产生白色沉淀和无色气体 | |
| B. | 肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 | |
| C. | 水泥厂、冶金厂常用高压电除工厂烟尘,以减少对空气的污染 | |
| D. | 牛油与烧碱溶液共热,向反应所得溶液中加入食盐,则有固体析出 |
3.0.1mol•L-1 KHS溶液中pH=11,下列表达式不正确的是( )
| A. | c(K +)+c(H+)=c(OH-)+c(HS-)+2 c(S2-) | B. | c(K+)>c(HS-)>c(OH-)>c(H+)>c(S2-) | ||
| C. | c(HS-)+c(S2-)+c(H2S)=0.1 mol•L-1 | D. | c(OH-)=2c(H2S)+c(H+)+c(HS-) |
 完成下列各小题.
完成下列各小题.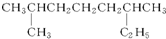 系统命名:2,6二甲基辛烷;
系统命名:2,6二甲基辛烷; ;
;