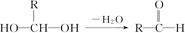题目内容
完全燃烧甲酸、乙酸和乙二酸的混合酸m g后,恢复到标准状况下得到2.24 L二氧化碳气体。如果完全中和上述m g混合酸,需要1 mol·L-1的氢氧化钠溶液80 mL。试通过计算求出原混合酸m g的取值范围。
3.9 g≤m g≤3.96 g
(NaOH)="1" mol·L-1×0.08 L="0.08" mol
设m g混合酸中含甲酸、乙酸和乙二酸的物质的量分别为x、y、z。
CO2 ~ C H+ ~ OH-
22.4 L 1 mol 1 mol 1 mol
22.4 L 0.1 mol 0.08 mol 0.08 mol
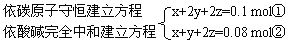
列出方程组
解得 y="0.02" mol m (乙酸)="0.02" mol×60 g·mol-1="1.2" g
推出混合酸中甲酸和乙二酸共0.06 mol
极端假设除乙酸外的混合酸全部是甲酸时, x="0.06" mol
m (甲酸)="0.06" mol×46 g·mol-1="2.76" g
m (混合酸)="2.76" g+1.2 g="3.96" g
极端假设作乙酸外的混合酸全部是乙二酸时,z="0.06" mol÷2="0.03" mol
m (乙二酸)="0.03" mol×90 g·mol-1="2.7" g
m (混合酸)="2.7" g+1.2 g="3.9" g
混合酸m g取值范围是3.9 g≤m g≤3.96 g。
设m g混合酸中含甲酸、乙酸和乙二酸的物质的量分别为x、y、z。
CO2 ~ C H+ ~ OH-
22.4 L 1 mol 1 mol 1 mol
22.4 L 0.1 mol 0.08 mol 0.08 mol
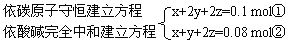
列出方程组
解得 y="0.02" mol m (乙酸)="0.02" mol×60 g·mol-1="1.2" g
推出混合酸中甲酸和乙二酸共0.06 mol
极端假设除乙酸外的混合酸全部是甲酸时, x="0.06" mol
m (甲酸)="0.06" mol×46 g·mol-1="2.76" g
m (混合酸)="2.76" g+1.2 g="3.96" g
极端假设作乙酸外的混合酸全部是乙二酸时,z="0.06" mol÷2="0.03" mol
m (乙二酸)="0.03" mol×90 g·mol-1="2.7" g
m (混合酸)="2.7" g+1.2 g="3.9" g
混合酸m g取值范围是3.9 g≤m g≤3.96 g。

练习册系列答案
 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
 已知一个碳原子上连有两个羟基时,易发生下列转化:
已知一个碳原子上连有两个羟基时,易发生下列转化: