题目内容
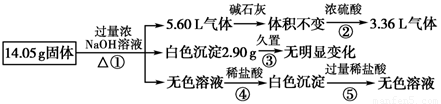
某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、CuCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):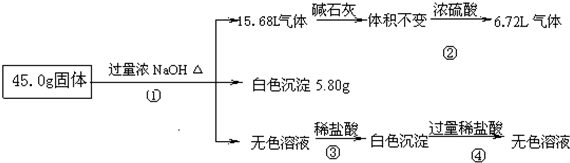
回答下列问题:
(1)混合物中是否存在CuCl2
(2)混合物中是否存在(NH4)2SO4
(3)写出反应③中的离子方程式
(4)请根据计算结果判断混合物中是否含有AlCl3(说出你的计算依据,不要求写计算过程).

回答下列问题:
(1)混合物中是否存在CuCl2
否
否
(填“是”或“否”);(2)混合物中是否存在(NH4)2SO4
是
是
(填“是”或“否”),你的判断依据是气体通过浓硫酸减少8.96L
气体通过浓硫酸减少8.96L
.(3)写出反应③中的离子方程式
H++OH-=H2O、[Al(OH)4]-+H+=Al(OH)3↓+H2O
H++OH-=H2O、[Al(OH)4]-+H+=Al(OH)3↓+H2O
.(4)请根据计算结果判断混合物中是否含有AlCl3(说出你的计算依据,不要求写计算过程).
由题中信息可推得一定含有Al、(NH4)2SO4和MgCl2三种物质,三者质量之和等于41.3g,小于固体总质量45.0g,所以原混合物中一定含有AlCl3
由题中信息可推得一定含有Al、(NH4)2SO4和MgCl2三种物质,三者质量之和等于41.3g,小于固体总质量45.0g,所以原混合物中一定含有AlCl3
.分析:45.0g固体加入过量的氢氧化钠溶液产生气体,有铵盐和碱反应生成生成的氨气,也可以是金属铝与氢氧化钠溶液反应生成氢气,15.68L气体通过碱石灰无变化,说明气体中无与碱石灰反应的气体,无水蒸气的存在,通过浓硫酸,气体剩余6.72L,体积减少15.68L-6.72L=8.96L,结合混合物可能存在的物质可知,一定含有硫酸铵与氢氧化钠反应生成氨气为8.96L,剩余的气体只能是氢气,体积为6.72L,说明原混合物中一定含有铝;45.0g固体加入过量的氢氧化钠溶液中产生白色沉淀5.8g,久置无变化,由于氢氧化铝溶于强碱,所以能生成白色沉淀的一定氯化镁生成的氢氧化镁白色沉淀,质量为5.8g,不存在CuCl2;45.0g固体加入过量的氢氧化钠溶液得到无色溶液,加入适量盐酸 会生成沉淀,说明金属铝或氯化铝与过量碱反应生成的偏铝酸钠与盐酸反应生成的氢氧化铝沉淀,加入过量盐酸沉淀溶解进一步证明沉淀是氢氧化铝,以此解答该题.
解答:解:45.0g固体加入过量的氢氧化钠溶液产生气体,有铵盐和碱反应生成生成的氨气,也可以是金属铝与氢氧化钠溶液反应生成氢气,15.68L气体通过碱石灰无变化,说明气体中无与碱石灰反应的气体,无水蒸气的存在,通过浓硫酸,气体剩余6.72L,体积减少15.68L-6.72L=8.96L,结合混合物可能存在的物质可知,一定含有硫酸铵与氢氧化钠反应生成氨气为8.96L,剩余的气体只能是氢气,体积为6.72L,说明原混合物中一定含有铝;45.0g固体加入过量的氢氧化钠溶液中产生白色沉淀5.8g,久置无变化,由于氢氧化铝溶于强碱,所以能生成白色沉淀的一定氯化镁生成的氢氧化镁白色沉淀,质量为5.8g,不存在CuCl2;45.0g固体加入过量的氢氧化钠溶液得到无色溶液,加入适量盐酸 会生成沉淀,说明金属铝或氯化铝与过量碱反应生成的偏铝酸钠与盐酸反应生成的氢氧化铝沉淀,加入过量盐酸沉淀溶解进一步证明沉淀是氢氧化铝,
(1)由以上分析可知固体中不存在CuCl2,故答案为:否;
(2)15.68L气体通过碱石灰无变化,说明气体中无与碱石灰反应的气体,无水蒸气的存在,通过浓硫酸,气体剩余6.72L,体积减少15.68L-6.72L=8.96L,结合混合物可能存在的物质可知,一定含有硫酸铵与氢氧化钠反应生成氨气为8.96L,剩余的气体只能是氢气,体积为6.72L,
故答案为:是;气体通过浓硫酸减少8.96L;
(3)45.0g固体加入过量的氢氧化钠溶液得到无色溶液,加入适量盐酸会生成沉淀,说明金属铝或氯化铝与过量碱反应生成的偏铝酸钠,与盐酸反应生成的氢氧化铝沉淀,加入过量盐酸沉淀溶解进一步证明沉淀是氢氧化铝,反应③中涉及到酸碱中和以及酸与四羟基合铝离子的反应,反应的离子方程式为H++OH-=H2O、
[Al(OH)4]-+H+=Al(OH)3↓+H2O,
故答案为:H++OH-=H2O、[Al(OH)4]-+H+=Al(OH)3↓+H2O;
(4)n(H2)=
=0.3mol,则n(Al)=0.2mol,m(Al)=0.152mol×27g/mol=5.4g,
n(NH3)=
=0.4mol,n((NH4)2SO4)=0.2mol,m((NH4)2SO4)=0.2mol×132g/mol=26.4g,
n(Mg(OH)2)=
=0.1mol,n(MgCl2)=0.1mol,m(MgCl2)=0.1mol×95g/mol=9.5g,
则Al、(NH4)2SO4和MgCl2三种物质,三者质量之和等于5.4g+26.4g+9.5g=41.3g,小于固体总质量45.0g,所以原混合物中一定含有AlCl3.
故答案为:由题中信息可推得一定含有Al、(NH4)2SO4和MgCl2三种物质,三者质量之和等于41.3g,小于固体总质量45.0g,所以原混合物中一定含有AlCl3.
(1)由以上分析可知固体中不存在CuCl2,故答案为:否;
(2)15.68L气体通过碱石灰无变化,说明气体中无与碱石灰反应的气体,无水蒸气的存在,通过浓硫酸,气体剩余6.72L,体积减少15.68L-6.72L=8.96L,结合混合物可能存在的物质可知,一定含有硫酸铵与氢氧化钠反应生成氨气为8.96L,剩余的气体只能是氢气,体积为6.72L,
故答案为:是;气体通过浓硫酸减少8.96L;
(3)45.0g固体加入过量的氢氧化钠溶液得到无色溶液,加入适量盐酸会生成沉淀,说明金属铝或氯化铝与过量碱反应生成的偏铝酸钠,与盐酸反应生成的氢氧化铝沉淀,加入过量盐酸沉淀溶解进一步证明沉淀是氢氧化铝,反应③中涉及到酸碱中和以及酸与四羟基合铝离子的反应,反应的离子方程式为H++OH-=H2O、
[Al(OH)4]-+H+=Al(OH)3↓+H2O,
故答案为:H++OH-=H2O、[Al(OH)4]-+H+=Al(OH)3↓+H2O;
(4)n(H2)=
| 6.72L |
| 22.4/mol |
n(NH3)=
| 8.96L |
| 22.4L/mol |
n(Mg(OH)2)=
| 5.8g |
| 58g/mol |
则Al、(NH4)2SO4和MgCl2三种物质,三者质量之和等于5.4g+26.4g+9.5g=41.3g,小于固体总质量45.0g,所以原混合物中一定含有AlCl3.
故答案为:由题中信息可推得一定含有Al、(NH4)2SO4和MgCl2三种物质,三者质量之和等于41.3g,小于固体总质量45.0g,所以原混合物中一定含有AlCl3.
点评:本题综合考查物质的检验和鉴别的实验方案的设计和评价,侧重于物质化学性质的综合应用,注意把握相关物质的性质以及反应现象,结合生成物物质的质量以及反应现象进行推断,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的一种或几种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):

下列说法正确的是( )

下列说法正确的是( )
| A、固体混合物中一定含有Al,但质量不可确定 | B、固体混合物中可能含有MgCl2和AlCl3 | C、固体混合物中一定含有MgCl2和FeCl2 | D、固体混合物中一定含有(NH4)2SO4、MgCl2 |