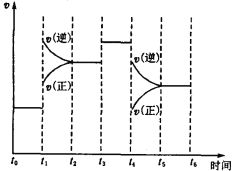
题目内容
【题目】已知有以下物质相互转化

试回答:
(1)写出B的化学式___________________,D的化学式_________________________。
(2)写出由E转变成F的化学方程式______________________________________。
(3)写出F转化成G的离子方程式________________________________________。
【答案】FeCl2 KCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Fe(OH)3+3H+=Fe3++3H2O
【解析】
根据D溶液与AgNO3溶液反应生成不溶于硝酸的白色沉淀H,因此H是AgCl,同时得到的溶液的焰色反应为紫色,说明D是KCl;根据白色沉淀E遇到空气变成红褐色沉淀F,可知E为Fe(OH)2,F为Fe(OH)3,G为FeCl3;根据B溶液和C溶液可以生成Fe(OH)2和KCl溶液,则B为FeCl2,C为KOH;A+G→B,A可以转化成B和气体,A为Fe;
(1)B的化学式为FeCl2,D的化学式为KCl。
(2)E转变为F的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(3)F转化为G的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O。

 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】氢能是一种极具发展潜力的清洁能源,CH4—H2O催化重整是目前大规模制取氢气的重要方法。
(1)CH4-H2O催化重整:
反应Ⅰ:CH4(g)+H2O(g)![]() CO(g)+3H2(g) H1 = +210kJ/mol
CO(g)+3H2(g) H1 = +210kJ/mol
反应Ⅱ: CO(g)+ H2O(g)![]() CO2(g)+H2(g) H2 =﹣41kJ/mol
CO2(g)+H2(g) H2 =﹣41kJ/mol
①提高CH4平衡转化率的条件是________。
a.增大压强 b.加入催化剂 c.增大水蒸气浓度
②CH4、H2O催化重整生成CO2、H2的热化学方程式是________。
③在密闭容器中,将2.0 mol CO与8.0 mol H2O混合加热到800℃发生反应Ⅱ,达到平衡时CO的转化率是80%,其平衡常数为 _________。
(2)实验发现,其他条件不变,相同时间内,向催化重整体系中投入一定量的CaO可以明显提高H2的百分含量。做对比实验,结果如下图所示:

①投入CaO时,H2百分含量增大的原因是:_________。
②投入纳米CaO时,H2百分含量增大的原因是:__________。
(3)反应中催化剂活性会因积炭反应而降低,相关数据如下表:
反应 | Ⅰ | Ⅱ |
|
| |
H(kJ/mol) | +75 | ﹣173 |
①研究发现,如果反应Ⅰ不发生积炭过程,则反应Ⅱ也不会发生积炭过程。因此,若保持催化剂的活性,应采取的条件是_________。
②如果Ⅰ、Ⅱ均发生了积炭反应,通入过量水蒸气能有效清除积炭,反应的化学方程式是_________。
【题目】反应CO(g)+2H2(g)CH3OH(g).反应的平衡常数如表:下列说法正确的是( )
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×102 | 2.4×104 | 1×105 |
A. 该反应的△H>0
B. 加压缩体积或增大CO浓度都能提高CO的转化率
C. 工业上采用高温高压的条件,目的都是提高原料气的转化率
D. t℃时,向1L密闭容器中投入0.1molCO和0.2molH2,平衡时CO转化率为50%,则该反应温度在0-100℃之间