题目内容
6.下列说法正确的是( )| A. | 一个水分子与其他水分子之间只能形成2个氢键 | |
| B. | 含氢键的分子熔沸点一定比不含氢键的分子熔沸点高 | |
| C. | 分子间作用力常包括氢键和范德华力 | |
| D. | 当水有液态变为气态时只破坏了氢键 |
分析 A.每个水分子与相邻四个水分子形成四个氢键;
B.形成分子内氢键,熔、沸点降低;
C.分子间作用力,又称范德华力,氢键属于分子间作用力的一种;
D.当H2O由液体变为气体时既破坏了氢键,又破坏了范德华力.
解答 解:A.水分子中氧原子含有一对孤对电子,O原子电负性较大,可以和其它的水分子形成两个氢键,含有的两个氢原子,可以分别和其它的水分子的氧原子形成两个氢键,所以以一个水分子为中心的正四面体结构,每个水分子与相邻四个水分子形成四个氢键,故A错误;
B.分子内形成氢键,那么相应的分子间的作用力就会减少,所以物质的熔沸点降低,故B错误;
C.分子间作用力指存在于分子与分子之间或惰性气体原子间的作用力,又称范德华力,氢键属于一种特殊的分子间作用力,存在于分子与分子之间,或分子内,故C正确;
D.H2O分子中电负性较强的氧原子有孤电子对,可以和其它的水分子形成氢键,当H2O由液体变为气体时,氢键随着分子间距离越大而逐渐消失,但范德华力随着分子间的距离变大而变小不会消失,故D错误,
故选C.
点评 本题主要考查了氢键和范德华力,掌握氢键的含义是解答的关键,题目难度不大,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
14.下列操作中错误的是( )
| A. | 用碘化钾淀粉试纸、食醋可检验食盐是否为加碘盐(加碘盐含碘酸钾KIO3) | |
| B. | 在浓硫酸的作用下,苯在50~60℃下可以与浓硝酸发生取代反应生成硝基苯 | |
| C. | 取一定量的Ba(OH)2•8H2O晶体和NH4Cl晶体于烧杯中搅拌,烧杯壁下部变冷 | |
| D. | 提取溶解在水中的少量碘:加入CCl4振荡、静置分层后,取出上层分离提取 |
14.根据碳原子成键的特点,碳原子可以相互结合成碳链或碳环.你认为C4H8可能的同分异构体有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
1.下列既能发生氧化还原反应,又能发生复分解反应的离子组是( )
| A. | Na+、H+、ClO-、S2- | B. | NH4+、Na+、MnO4-、I- | ||
| C. | K+、Ba2+、Br-、NO3- | D. | Mg2+、Ag+、OH-、PO43- |
11.下列离子方程式书写正确的是( )
| A. | 钠跟水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 稀盐酸与苏打溶液反应:HCO3-+H+═CO2↑+H2O | |
| C. | 铁盐腐蚀电路板:2Fe3++Cu═2Fe2++Cu2+ | |
| D. | 次氯酸钙溶液中通入过量二氧化碳 Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO |
18.下列有关电解质溶液中粒子浓度关系正确的是( )
| A. | 将 HCl 与 CH3COONa 两溶液混合后,溶液呈中性,则 c(Na+ )<c(Cl- ) | |
| B. | 向 NH4Cl 溶液中通 NH3,则 c(NH4+ )>c(Cl- )>c(OH- )>c(H+ ) | |
| C. | 室温下,c(NH4+ )相同的①(NH4)2 CO3②(NH4)2 SO4 ③(NH4)2 Fe(SO4)2溶液浓度大小顺序为:①>②>③ | |
| D. | 已知 pKa=-lgKa,pKa(HF)=3.1,pKa(C6H5COOH)=4.2,室温下,等体积、等浓度的 NaF、C6H5COONa 溶液中,前者离子总数小于后者 |
15.下列过程中吸收能量的是( )
| A. |  | B. |  | ||
| C. | 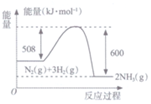 | D. |  |
20.某烷烃的各种同分异构体中,主链上有4个碳原子的 只有两种,则含有相同碳原子数且主链上也有4个碳原子的单烯烃有( )
| A. | 2种 | B. | 3 种 | C. | 4种 | D. | 5种 |