题目内容
某无色溶液X,由Na+、Ag+、Ba2+、Al3+、Al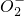 、Mn
、Mn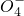 、CO32-、S
、CO32-、S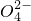 中的若干种离子组成,取溶液进行如下连续实验:
中的若干种离子组成,取溶液进行如下连续实验:

(1)白色沉淀甲是______.
(2)X溶液中一定存在的离子是______.
(3)白色沉淀乙中一定有:______,可能有______证明其是否存在的方法是______.
(4)若将过量的气体A与适量的气体B通入水中,写出反应的离子方程式______.
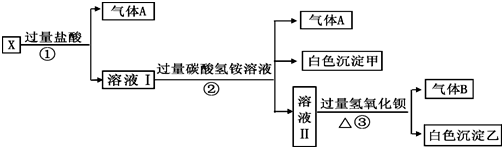
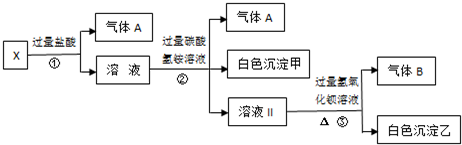
解:分析题干转化关系和现象,无色溶液,判断MnO4-不存在,加过量盐酸生成气体和溶液,判断溶液中无Ag+、一定含CO32-;则一定不含有Ba2+、Al3+;气体A为CO2;溶液I加入过量碳酸氢铵反应生成二氧化碳,白色沉淀甲是偏铝酸根离子和过量盐酸反应生成的铝离子与碳酸根或碳酸氢根水解生成的氢氧化铝沉淀,判断原溶液一定含有AlO2-;溶液Ⅱ加入过量氢氧化钡生成气体B为NH3,沉淀乙为碳酸钡沉淀或碳酸钡和硫酸钡沉淀的混合物;根据溶液电中性阳离子一定含有Na+;判断原溶液中一定含有CO32-;AlO2-;Na+;一定不含有Ba2+、Al3+;MnO4-;Ag+;可能含有SO42-;
(1)白色沉淀甲为Al(OH)3;故答案为:Al(OH)3;
(2)X溶液中一定存在的离子是CO32-;AlO2-;Na+;故答案为:CO32-;AlO2-;Na+;
(3)白色沉淀乙中一定有BaCO3,可能有BaSO4,检验方法:取少量沉淀放在试管中,加入硝酸,沉淀部分溶解,证明沉淀中含硫酸钡,沉淀全部溶解在,不含硫酸钡沉淀;
故答案为:BaCO3 BaSO4 取少量沉淀放在试管中,加入硝酸,沉淀部分溶解,证明沉淀中含硫酸钡,沉淀全部溶解在,不含硫酸钡沉淀;
(4)将过量的气体A为CO2与适量的气体B为NH3通入水中,反应的离子方程式:CO2+NH3+H2O=NH4++HCO3-;
故答案为:CO2+NH3+H2O=NH4++HCO3-;
分析:无色溶液,判断MnO4-不存在,加过量盐酸生成气体和溶液,判断溶液中无Ag+、一定含CO32-;则一定不含有Ba2+、Al3+;气体A为CO2;溶液I加入过量碳酸氢铵反应生成二氧化碳,白色沉淀甲是偏铝酸根离子和过量盐酸反应生成的铝离子与碳酸根或碳酸氢根水解生成的氢氧化铝沉淀,判断原溶液一定含有AlO2-;溶液Ⅱ加入过量氢氧化钡生成气体B为NH3,沉淀乙为碳酸钡沉淀或碳酸钡和硫酸钡沉淀的混合物;根据溶液电中性阳离子一定含有Na+;
点评:本题考查了离子检验的方法应用,主要是离子共存的正确判断,注意离子量的不同,反应生成的离子不同,题目难度中等.
(1)白色沉淀甲为Al(OH)3;故答案为:Al(OH)3;
(2)X溶液中一定存在的离子是CO32-;AlO2-;Na+;故答案为:CO32-;AlO2-;Na+;
(3)白色沉淀乙中一定有BaCO3,可能有BaSO4,检验方法:取少量沉淀放在试管中,加入硝酸,沉淀部分溶解,证明沉淀中含硫酸钡,沉淀全部溶解在,不含硫酸钡沉淀;
故答案为:BaCO3 BaSO4 取少量沉淀放在试管中,加入硝酸,沉淀部分溶解,证明沉淀中含硫酸钡,沉淀全部溶解在,不含硫酸钡沉淀;
(4)将过量的气体A为CO2与适量的气体B为NH3通入水中,反应的离子方程式:CO2+NH3+H2O=NH4++HCO3-;
故答案为:CO2+NH3+H2O=NH4++HCO3-;
分析:无色溶液,判断MnO4-不存在,加过量盐酸生成气体和溶液,判断溶液中无Ag+、一定含CO32-;则一定不含有Ba2+、Al3+;气体A为CO2;溶液I加入过量碳酸氢铵反应生成二氧化碳,白色沉淀甲是偏铝酸根离子和过量盐酸反应生成的铝离子与碳酸根或碳酸氢根水解生成的氢氧化铝沉淀,判断原溶液一定含有AlO2-;溶液Ⅱ加入过量氢氧化钡生成气体B为NH3,沉淀乙为碳酸钡沉淀或碳酸钡和硫酸钡沉淀的混合物;根据溶液电中性阳离子一定含有Na+;
点评:本题考查了离子检验的方法应用,主要是离子共存的正确判断,注意离子量的不同,反应生成的离子不同,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 、CO
、CO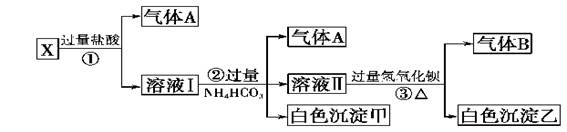 1)气体A的成分是:_________________,气体B的成分是_____________
1)气体A的成分是:_________________,气体B的成分是_____________