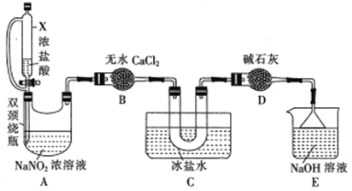
题目内容
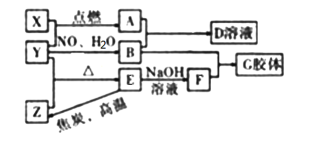
【题目】废物的处理、转化和利用是非常有意义的。某研究性学习小组设计如图所示流程,综合处理某工厂印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)和废气(H2S),真正做到了变废为宝:处理废液、废气得到氯化铜、单质硫的同时,还实现了蚀刻液的循环利用。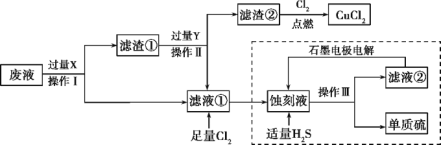
根据以上信息回答下列问题:
(1)操作I、Ⅱ、Ⅲ相同,名称是__,所需要的玻璃仪器主要有:烧杯、玻璃棒、__。
(2)通常用来检验蚀刻液中金属阳离子的化学试剂是__。
(3)向废液中加入过量X时发生的主要反应的离子方程式为__。
(4)滤渣①与Y反应的化学方程式为____。
(5)H2S通入蚀刻液中发生的主要反应为___。
(6)电解池中H+在阴极放电产生H2,阳极的电极反应式为__。
(7)综合分析虚线框内所涉及的两个反应,可知该过程有两个显著优点:①蚀刻液得到循环利用;②__。
【答案】过滤 漏斗 KSCN溶液 2Fe3++Fe=3Fe2+,Cu2++Fe=Fe2++Cu Fe+2HCl=FeCl2+H2↑ 2FeCl3+H2S=2FeCl2+S↓+2HCl 或2Fe3++H2S=2Fe2++S↓+2H+ 2Fe2+-2e-=2Fe3+ 硫化氢的原子利用率为100%
【解析】
根据流程图,滤液①中通入足量的氯气,能够生成蚀刻液(FeCl3),因此滤液①为FeCl2,则废液(含Fe3+、Cu2+、Fe2+、Cl-)加入过量的X为铁粉,三价铁离子与铁反应生成二价铁离子,铜离子与铁反应生成铜和二价铁离子,经过过滤得到滤渣①为铜与铁,滤液①为氯化亚铁溶液,滤渣①中加入过量的Y得到氯化亚铁溶液,因此Y为盐酸,铁与盐酸反应生成氯化亚铁,铜与盐酸不反应,过滤得到滤渣②为铜,铜与氯气反应生成氯化铜,滤液①通入足量氯气生成氯化铁,氯化铁与硫化氢反应生成硫单质和氯化亚铁,过滤得到单质硫和滤液②为氯化亚铁,电解可以生成氯化铁。据此分析解答。
(1)由流程图可知,操作Ⅰ、Ⅱ、Ⅲ都是分离固体与液体的操作,应为过滤操作,用到的玻璃仪器主要有:烧杯、玻璃棒、漏斗,缺少的仪器为:漏斗,故答案为:过滤;漏斗;
(2)滤渣②与氯气反应得到氯化铜,则滤渣②为铜,氯化铁与铜反应生成氯化铁和氯化铜,所以刻蚀液主要为三氯化铁,检验三价铁离子,可以用KSCN溶液,如果加入KSCN溶液出现血红色,证明含有三价铁离子,故答案为:KSCN溶液;
(3)根据上述分析,X为铁,铁能够与溶液中三价铁离子,铜离子发生反应,离子方程式依次是:2Fe3++Fe=3Fe2+,Cu2++Fe=Fe2++Cu,故答案为:2Fe3++Fe=3Fe2+,Cu2++Fe=Fe2++Cu;
(4)滤渣①为铜和过量的铁,除去铁,应加入过量的盐酸,所以Y为盐酸,铜与盐酸不反应,铁与盐酸反应生成氯化亚铁,反应的化学方程式:Fe+2HCl=FeCl2+H2↑,故答案为:Fe+2HCl=FeCl2+H2↑;
(5)刻蚀液为氯化铁,通入硫化氢发生氧化还原反应,反应的化学方程式为:,离子方程式为2FeCl3+H2S=2FeCl2+S↓+2HCl,故答案为:2FeCl3+H2S=2FeCl2+S↓+2HCl 或2Fe3++H2S=2Fe2++S↓+2H+;
(6)氯化铁与硫化氢反应生成硫单质和氯化亚铁、氯化氢,过滤得到滤渣为硫单质,滤液为氯化亚铁和盐酸,电解二者的混合物,阳极上Fe2+失去电子发生氧化反应生成Fe3+,电极反应式为:2Fe2+-2e-=2Fe3+,故答案为:2Fe2+-2e-=2Fe3+;
(7)依据氯化铁与硫化氢反应可知硫化氢在反应中原子利用率为100%,故答案为:硫化氢的原子利用率为100%。

 名校课堂系列答案
名校课堂系列答案【题目】(14分)某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4 ·4H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
① | 4 | B= | 10 | 30 |
② | 5 | 60 | 10 | d= |
③ | a= | 60 | c= | 20 |
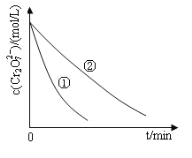
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化为 (填化学式);
(3)实验①和②的结果表明_______________________________;
(4)该课题组对铁明矾[Al2Fe(SO4)4 ·4H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;假设二: ;假设三: ;……
(5)请你设计实验验证上述假设一,完成下表中内容。(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。(溶液中Cr2O72-的浓度可用仪器测定)
实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
取_______________________________代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 | 反应进行相同时间后, 若溶液中的Cr2O72-浓度____________________________则假设一成立; 若溶液中的Cr2O72-浓度____________________________则假设一不成立; |
(6)铁明矾长期存放,其中的亚铁离子可能会变质。为测定铁明矾中亚铁离子的质量分数。取5.6g铁明矾晶体,将其配制为100ml的溶液,取出20ml置于锥形瓶中。用0.01mol/L的标准KMnO4溶液进行滴定(还原产物为Mn2+),平行做4组实验,得出如下表数值。
组数 | 1 | 2 | 3 | 4 |
消耗V(KMnO4)/ml | 20.04 | 20.00 | 18.90 | 19.96 |
请计算铁明矾中亚铁离子的质量分数: 。若滴定结束后读数时仰视,测定结果 (填“偏大”“不影响”或“偏小”)