题目内容
(11分)有A、B、C三种元素,A元素是所有元素中原子半径最小的元素,B、C两元素的核外电子层数相同,C元素的单质为深棕红色液体,B元素的最高价阳离子0.5 mol被还原成中性原子时,需得到1 mol电子,当它同盐酸反应时,放出0.02 g H2,用去B元素0.4 g,则
(1)A元素为______________,B元素为______________,C元素为_______________。
(2)用电子式表示A与C,B与C形成化合物的过程:______________、______________,化学键分别是_________________、_________________。
(1)A元素为______________,B元素为______________,C元素为_______________。
(2)用电子式表示A与C,B与C形成化合物的过程:______________、______________,化学键分别是_________________、_________________。
(1)氢 钙 溴
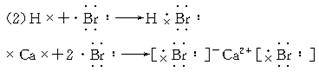
共价键 离子键
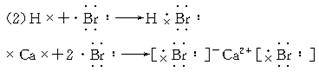
共价键 离子键
由题给条件可知,A元素是所有元素中原子半径最小的元素,只有H元素才符合此条件,故A为H,由C元素的单质在常温常压时为深棕红色液体得知C为Br,B与C核外电子层数相同,即两元素为同周期元素,所以B为第四周期元素,由题可知B的最高正价为+2价,并且B的相对原子质量为40,由此可知B为Ca元素。

练习册系列答案
相关题目
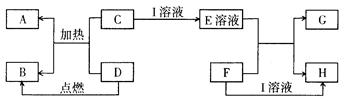
 分别代表有关反应中的一种物质,请填下以下空白。
分别代表有关反应中的一种物质,请填下以下空白。