题目内容
右图是周期表的一部分,A、B、C、D、E 5种元素的原子核外共含有80个电子。
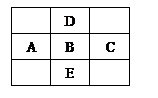
(1)A、B、C、D的元素符号分别是:
A ,B ,C ,
D ,
(2)A、B、C的的酸性由强到弱的顺序是(用化学式表示)
。
(3)A的最高价氧化物对应的水化物体现 (填“酸性 ”、“碱性”、“两性”),用离子方程式表示为: 、
。
(4)E为 (填“金属”、“非金属”),其单质可能为 (填“导体”、“非导体”、“半导体”),推断理由是

(1)A、B、C、D的元素符号分别是:
A ,B ,C ,
D ,
(2)A、B、C的的酸性由强到弱的顺序是(用化学式表示)
。
(3)A的最高价氧化物对应的水化物体现 (填“酸性 ”、“碱性”、“两性”),用离子方程式表示为: 、
。
(4)E为 (填“金属”、“非金属”),其单质可能为 (填“导体”、“非导体”、“半导体”),推断理由是
1)Al Si P C (2)H3PO4>H2SiO3>Al(OH)3
(3)两性,Al(OH)3+ 3H+ ="==" Al3++3H2O,
Al(OH)3+ OH—— ="==" AlO2-+2H2O
(4)金属,半导体,在周期表中处在金属元素和非金属元素分界线附近
(3)两性,Al(OH)3+ 3H+ ="==" Al3++3H2O,
Al(OH)3+ OH—— ="==" AlO2-+2H2O
(4)金属,半导体,在周期表中处在金属元素和非金属元素分界线附近
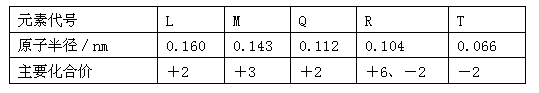
试题分析:由图可以判断出,D元素不可能在第一周期,假如D在第二周期,那设B的电子数为x,则A的电子数为x-1,C的电子数为x+1,D的电子数为x-8,E的电子数为x+18,依题意可得x+(x-1)+(x+1)+(x-8)+(x+18)=80,得x=14,即B为Si,A为Al,C为P,D为C,E为Ge。
(1)ABCD依次为Al Si P C
(2)A的最高价氧化物对应的水化物是Al(OH)3,为两性,B的最高氧化物对应的水化物是H2SiO3,为弱酸,C的最高氧化物对应的水化物是H3PO4,虽然它不是强酸,但酸性比弱酸强很多,属于中强酸。故酸性的排列顺序为H3PO4>H2SiO3>Al(OH)3
(3)A的最高价氧化物对应的水化物是Al(OH)3,体现了两性,既能和酸反应,生成铝盐和水,也能与强碱反应,生成偏铝酸盐和水。
(4)E为锗,属于金属,锗是半导体,原因是在周期表中处于金属和非金属分界线的附近。
点评:此题考核了元素周期表的认识,通过推断元素,然后根据所学元素的性质作答,难度不大。

练习册系列答案
相关题目
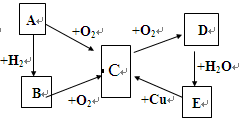
 E+ F↑+H2O
E+ F↑+H2O