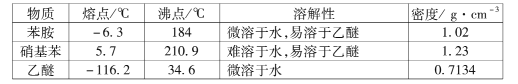
题目内容
【题目】分离出合成气中的H2,用于氢氧燃料电池。如图为电池示意图。
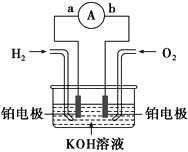
(1)氢氧燃料电池的能量转化主要形式是___,在导线中电子流动方向为___(用a、b和箭头表示)。
(2)正极反应的电极反应方程式为___。
(3)当电池工作时,在KOH溶液中阴离子向___移动(填正极或负极)。
【答案】化学能转化为电能 a→b O2+4e-+2H2O=4OH- 负极
【解析】
燃料电池的工作原理属于原电池原理,是化学能转化为电能的装置,原电池中,电流从正极流向负极,电子流向和电流流向相反;燃料电池中,通入燃料的电极是负极,通氧气的电极是正极,正极上是氧气发生得电子的还原反应。
(1) 该题目中,氢氧燃料电池的工作原理属于原电池原理,是将化学能转化为电能的装置,在原电池中,电流从正极流向负极,而通入燃料氢气的电极是负极,通氧气的电极是正极,所以电子从a移动到b;
(2)燃料电池中,通入燃料氢气的电极是负极,通氧气的电极是正极,正极上的电极反应为:
O2+ 2H2O+4e-=4OH-,故答案为: O2+2H2O+4e-=4OH-;
(3)根据离子间的阴阳相吸,当电池工作时,负极产生氢离子(阳离子),所以在KOH溶液中阴离子向负极移动。

练习册系列答案
相关题目