题目内容
【题目】以含有Al2O3、Fe2O3等杂质的铬铁矿[主要成分为Fe(CrO2)2]为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O)的主要工艺流程如下:

已知:铬铁矿在空气中与纯碱煅烧生成Na2CrO4和一种红棕色固体,同时释放出CO2气体,且Al2O3+Na2CO3![]() 2NaAlO2+CO2↑。请回答:
2NaAlO2+CO2↑。请回答:
(1)在铬铁矿Fe(CrO2)2中,Cr的化合价为 。
(2)滤渣2的成分为 。
(3)将滤渣1放入稀硫酸溶解后得溶液W,检验该溶液中金属离子的方法是 。
(4)根据有关国家标准,含CrO![]() 的废水要经化学处理,使其浓度降至5.0×10-7 mol/L以下才能排放。含CrO
的废水要经化学处理,使其浓度降至5.0×10-7 mol/L以下才能排放。含CrO![]() 的废水处理通常用以下方法:还原法:
的废水处理通常用以下方法:还原法:![]() 。写出酸性条件下CrO
。写出酸性条件下CrO![]() 与绿矾(FeSO4.7H2O)在溶液中反应的离子方程式:____________________________。
与绿矾(FeSO4.7H2O)在溶液中反应的离子方程式:____________________________。
【答案】(1)+3;(2)Al(OH)3;
(3)取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红,证明有Fe3+;
(4)CrO42-+3Fe2++8H+===Cr3++3Fe3++4H2O。
【解析】
试题分析:(1)氧为-2价,Fe为+2价,整个化合价代数和为0,Cr为+3价;(2)Fe2O3是碱性氧化物,不与纯碱反应,但Al2O3是两性氧化物,能与Na2CO3发生反应,因此滤渣1是氧化铁,浸出液中含有NaAlO2,因此通入CO2,发生CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-,因此滤渣2为氢氧化铝;(3)滤渣1的成分是Fe2O3,Fe2O3+6H+=2Fe3++3H2O,检验Fe3+用KSCN溶液,如果溶液变红,说明含有Fe3+,具体步骤是:取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红,证明有Fe3+;(4)Fe2+具有还原性,CrO42-具有氧化性,化合价由+6价→+3价,Fe2+→Fe3+,根据化合价升降法进行配平,其离子反应方程式为:CrO42-+3Fe2++8H+===Cr3++3Fe3++4H2O。

 应用题作业本系列答案
应用题作业本系列答案【题目】某同学进行下列实验:
装置 | 操作 | 现象 |
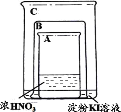
| 将盛有浓硝酸的烧杯A放入盛有淀粉KI溶液的烧杯C中,然后将铜片放入烧杯A后,立即用烧杯B罩住 | 烧杯A液体上方立即出现大量红棕色气体;一段时间后,红棕色气体消失,烧杯A和C中的液体都变成蓝色 |
下列说法合理的是
A.烧杯A中发生反应:3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O
B.红棕色气体消失只与NO2和烧杯C中的KI发生反应有关
C.烧杯C中溶液变蓝只与NO2和C中溶液发生反应有关
D.若将铜片换成铁片,则C中的液体也可能变蓝
【题目】
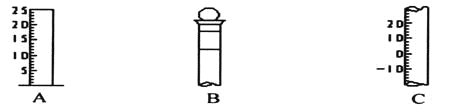
(1)请写出下列仪器的名称:A ,B ,C 。
(2)仪器B上标记有 (填序号)。
①质量 ②温度 ③刻度线 ④浓度 ⑤容积
Ⅱ.现用98%的浓H2SO4(密度为1.84g/cm3)来配制480mL0.2mol/L的稀H2SO4。
有关操作为:①计算所需浓硫酸的体积 ②量取一定体积的浓硫酸 ③稀释、冷却 ④转移、洗涤 ⑤定容 ⑥摇匀。回答下列问题
(3)应用量筒量取的浓硫酸体积是 mL,实验中所用的玻璃仪器除烧杯、玻璃棒、量筒、胶头滴管外还有 。
(4)第③步中稀释浓硫酸的操作是 。
(5)将所配制的稀H2SO4进行测定,发现实际浓度大于0.2mol/L。请你分析下列哪些操作会引起所配浓度偏大(填写字母) 。
A.用量筒量取浓硫酸时,仰视量筒的刻度 |
B.容量瓶未干燥即用来配制溶液 |
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容 |
D.往容量瓶转移时,有少量液体溅出 |
E.烧杯未进行洗涤
F.在容量瓶中定容时俯视容量瓶刻度线
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。