题目内容
【题目】根据要求回答下列问题。
(1)相同质量的SO2气体和SO3气体,其分子数之比为_____,氧原子数之比为_____,相同条件下(同温同压)的体积之比为_____,密度之比为_____。
(2)SO2与O2的混合气体中,氧元素的质量分数为70%,则SO2与O2的物质的量之比是_____,这种混合气体的密度是同温同压下氧气密度的_____倍。
(3)用2.4 mol·L-1的H2SO4溶液配制100 mL浓度为0.2 mol·L-1的稀硫酸,需量取2.4 mol·L-1的H2SO4溶液的体积是_____mL。
(4)试分析下列操作对所配溶液的浓度有何影响(填“偏高”“偏低”或“无影响”)。
①未洗涤烧杯和玻璃棒,使所配溶液浓度_____;
②定容时俯视刻度线,使所配溶液浓度_____;
③摇匀后,发现液面低于刻度线,又滴加蒸馏水,使所配溶液浓度_____。
【答案】5∶4 5∶6 5∶4 4∶5 3∶4 ![]() 8.3 偏低 偏高 偏低
8.3 偏低 偏高 偏低
【解析】
(1)设SO2与SO3均为1g,则n(SO2)=![]() =
=![]() mol,n(SO3)=
mol,n(SO3)=![]() =
=![]() mol,则SO2中n(O)=2n(SO2)=
mol,则SO2中n(O)=2n(SO2)=![]() mol,SO3中n(O)=
mol,SO3中n(O)=![]() mol,故分子数之比为
mol,故分子数之比为![]() ∶
∶![]() =5∶4,氧原子数之比为
=5∶4,氧原子数之比为![]() ∶
∶![]() =5∶6。据阿伏加德罗定律:体积之比等于物质的量之比,即V(SO2)∶V(SO3)=5∶4,密度之比等于摩尔质量之比,即ρ(SO2)∶ρ(SO3)=64∶80=4∶5;
=5∶6。据阿伏加德罗定律:体积之比等于物质的量之比,即V(SO2)∶V(SO3)=5∶4,密度之比等于摩尔质量之比,即ρ(SO2)∶ρ(SO3)=64∶80=4∶5;
(2)设有100 g混合物,则氧元素的质量为70 g,硫元素的质量为30 g,二氧化硫中硫元素的质量分数为50%,则二氧化硫的质量为![]() =60g,氧气的质量为100g-60g=40g,氧气的摩尔质量是32g·mol-1,二氧化硫的摩尔质量是64g·mol-1,SO2与O2的物质的量之比为
=60g,氧气的质量为100g-60g=40g,氧气的摩尔质量是32g·mol-1,二氧化硫的摩尔质量是64g·mol-1,SO2与O2的物质的量之比为![]() ∶
∶![]() =3∶4,同温同压下气体的密度比等于摩尔质量比,混合气体的密度比等于摩尔质量比,混合气体的平均摩尔质量为
=3∶4,同温同压下气体的密度比等于摩尔质量比,混合气体的密度比等于摩尔质量比,混合气体的平均摩尔质量为![]() g·mol-1=
g·mol-1=![]() g·mol-1,混合气体与氧气的平均摩尔质量比为
g·mol-1,混合气体与氧气的平均摩尔质量比为![]() ∶32=
∶32=![]() ∶1,所以混合气体的密度是氧气密度的
∶1,所以混合气体的密度是氧气密度的![]() 倍;
倍;
(3)根据稀释前后硫酸的物质的量不变可知:2.4 mol·L-1×V=0.100 L×0.2 mol·L-1,V=0.0083L,故需要量取2.4 mol·L-1的H2SO4溶液的体积是8.3 mL;
(4)误差分析根据公式c=![]() 进行分析,若未洗涤烧杯和玻璃棒,则n减小,V不变,c偏低;若定容时俯视,则使所加溶液体积变小,n不变,V减小,c偏高;若摇匀后发现低于液面再加蒸馏水,则会使V变大,由于n不变,则c偏低。
进行分析,若未洗涤烧杯和玻璃棒,则n减小,V不变,c偏低;若定容时俯视,则使所加溶液体积变小,n不变,V减小,c偏高;若摇匀后发现低于液面再加蒸馏水,则会使V变大,由于n不变,则c偏低。

 阅读快车系列答案
阅读快车系列答案【题目】图用分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )
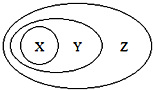
X | Y | Z | |
A | NaAlO2 | 盐 | 纯净物 |
B | 胶体 | 分散系 | 混合物 |
C | Al2O3 | 两性氧化物 | 氧化物 |
D | 单质参与反应 | 置换反应 | 氧化还原反应 |
A. A B. B C. C D. D