题目内容
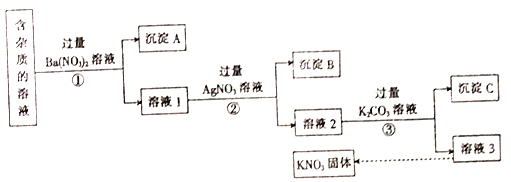
【题目】现有含少量KCl、K2SO4、KgCO3杂质的KNO3溶液,除去杂质,得到纯净KNO3固体的实验流程如图所示。
已知:KNO3固体受热易分解。
(1)沉淀A的主要成分是_______(填化学式)。
(2)过程②中进行的实验操作是__________。
(3)过程③中加入过量K2CO3溶液的目的是_________。
(4)为了除去溶液3中的杂质,可向其中加人适量的_______,而后获得KNO3晶体的操作是_____、______、过滤。
【答案】 BaSO4、BaCO3 过滤 除去Ba2+、Ag+ 稀硝酸 蒸发浓缩 冷却结晶
【解析】往含杂质的溶液中加入过量的硝酸钡溶液,过滤得到沉淀A为BaSO4、BaCO3,滤液为溶液1,含有氯化钾、硝酸钾及过量的硝酸钡,再往溶液1中加入过量硝酸银溶液,过滤得到沉淀B为:氯化银,滤液为溶液2,含有硝酸钾和过量的硝酸钡及硝酸银,往溶液2中加入过量碳酸钾溶液,过滤得到沉淀C为碳酸银、碳酸钡,滤液为溶液3,含有硝酸钾和过量的碳酸钾,溶液3通过蒸发浓缩、冷却结晶、过滤得到硝酸钾晶体。(1)沉淀A的主要成分是BaSO4、BaCO3;(2)过程②中进行的实验操作是过滤;(3)过程③中加入过量K2CO3溶液的目的是除去Ba2+、Ag+;(4)为了除去溶液3中的杂质K2CO3,可向其中加人适量的稀硝酸,而后获得KNO3晶体的操作是蒸发浓缩、冷却结晶、过滤。

 怎样学好牛津英语系列答案
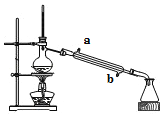
怎样学好牛津英语系列答案【题目】分某化学兴趣小组在实脸室模拟侯德榜制碱法制备纯碱。主要步骤如下:
第一步:配制饱和NaCl溶液,倒入烧杯中加热;
第一步:控制温度在30-35 ℃。边搅拌边分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟;
第三步:静置、过滤得NaHCO3晶体.用少量蒸馏水洗涤除去杂质,然后抽干;
第四步:将第二步所得固体转入蒸发皿中,灼烧2小时,制得纯碱固体,
已知:温度高于35℃时,NH4HCO3会分解。有关盐的溶解度(g/100g水)如下表:
盐 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | —— | —— | —— | —— |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.l | 12.7 | 14.5 | 16.4 | —— |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
回答下列问题:
(1)反应温度控制在30-35℃范围内,应采取的加热方法为 ,反应温度不能高于35℃的理由是 .
(2)第三步静置后析出NaHCO3晶体的原因是 ;用蒸馏水洗涤NaHCO3晶体的目的是除去杂质粒子 (用离子符号表示)。
(3)若向过滤所得母液中加入 (填写试剂名称),并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
(4)纯碱产品不纯,含有NaHCO3、NaCl等杂质。测定纯碱中NaHCO3含量的方法是:准确称取纯碱样品Wg,放入锥形瓶中加蒸馏水溶解,加l-2滴酚酞指示剂,用物质的量浓度为cmol/L的盐酸滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点), 所用盐酸体积为V1mL,再加1-2滴甲基橙指示剂,继续用盐酸滴定至溶液由黄变橙,所用盐酸总体积为V2mL。
① 实验室配制一定体积cmol/L盐酸需用的仪器除了容量瓶、烧杯、量筒外还需 ;在容量瓶的使用方法中,下列操作正确的是 (填写标号)
a.使用容量瓶前检验它是否漏水
b.容量瓶用蒸馏水洗净后,再用待配溶液润洗
c.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中.然后加蒸馏水定容
d.用容量瓶把溶液配制完成以后.直接贴上标签,放置备用
e.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手指托住瓶底,把容量瓶倒转和摇动几次
② 写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)= 。