题目内容
【题目】下表为元素周期表的一部分,用化学用语回答下列问题:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑧的原子结构示意图为______________________________________________。
(2)③⑧⑩的最高价含氧酸的酸性最强的是__________(填化学式)。
(3)③的气态氢化物与③的最高价氧化物对应的水化物反应生成盐的化学方程式是_______。
(4)①④⑩三种元素的原子能形成原子数目比为1∶1∶1的共价化合物,它的电子式为_____________,②④两种元素形成原子数目比为1∶2的共价化合物的结构式为___________________________。
(5)⑤的最高价氧化物的水化物与⑦的最高价氧化物反应的离子方程式为_________,⑨的最高价氧化物的水化物的浓溶液与铜反应的化学方程式为:____________________。
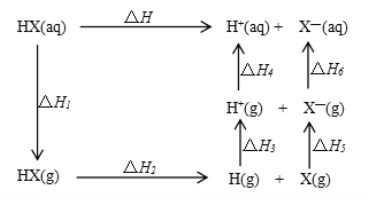
【答案】![]() HClO4 NH3+HNO3==NH4NO3
HClO4 NH3+HNO3==NH4NO3 ![]() O=C=O Al2O3+ 2OH- =2AlO2- +H2O Cu + 2H2SO4(浓)
O=C=O Al2O3+ 2OH- =2AlO2- +H2O Cu + 2H2SO4(浓) ![]() CuSO4 + SO2↑+2H2O
CuSO4 + SO2↑+2H2O
【解析】
根据元素在周期表的位置,推出①为H,②为C,③为N,④为O,⑤为Na,⑥为Mg,⑦为Al,⑧为P,⑨为S,⑩为Cl,然后根据元素及其化合物的性质分析即可;
(1)⑧为位于第三周期VA族,即⑧为P,15号元素,其原子结构示意图为![]() ;
;
(2)③为N,⑧为P,⑩为Cl,目前酸性最强的含氧酸为HClO4,即③⑧⑩中最高价含氧酸的酸性最强的是HClO4;
(3)③的气态氢化物为NH3,③的最高价氧化物对应的水化物是HNO3,两者反应方程式为NH3+HNO3=NH4NO3;
(4)①为H,④为O,⑩为Cl,组成原子数目比为1:1:1的共价化合物为HClO,其电子式为![]() ;②④组成原子数目比为1:2的化合物为CO2,C和O之间共用2个电子对,即CO2的结构式为O=C=O;
;②④组成原子数目比为1:2的化合物为CO2,C和O之间共用2个电子对,即CO2的结构式为O=C=O;
(5)⑤的最高价氧化物的水化物是NaOH,⑦的最高价氧化物为Al2O3,Al2O3为两性氧化物,Al2O3+2OH-=2AlO2-+H2O;⑨的最高价氧化物的水化物是H2SO4,Cu与浓硫酸反应:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。

 阅读快车系列答案
阅读快车系列答案【题目】下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
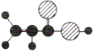
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为100的酯 |
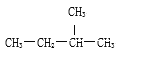
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)B具有的性质是_____(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:__________
(2)只用一种试剂就能将B、C、D鉴别出来,这种试剂可以是_______
①酚酞试液 ②氢氧化钠溶液 ③碳酸钠溶液 ④水 ⑤溴水
(3)C与D反应能生成相对分子质量为100的酯,其化学方程式为:______