题目内容
【题目】氯化铬晶体(CrCl3·6H2O)是一种重要的工业原料,工业上常用铬酸钠(Na2CrO4)来制备。实验室以红矾钠(Na2Cr2O7)为原料制备CrCl3·6H2O的流程如下:

已知:① Cr2O72-+H2O![]() 2CrO42-+2H+;
2CrO42-+2H+;
② CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
(1)写出碱溶发生反应的化学方程式____________________________________,所加40%NaOH不宜过量太多的原因是______________________________。
(2)还原时先加入过量CH3OH再加入10%HCl,生成CO2,写出该反应的离子方程式_________________,反应后从剩余溶液中分离出CH3OH的实验方法是_____________。
(3)使用下列用品来测定溶液的pH,合理的是_________(填字母)。
A.酚酞溶液 B.石蕊试纸 C.pH计
(4)请补充完整由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得的洁净固体 _______________________,蒸发浓缩,__________,过滤, ______________,低温干燥,得到CrCl3·6H2O(实验中可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚)。
(5)若取原料红矾钠26.2g,实验最终得到氯化铬晶体42.64g,则该实验的产率为_________。
【答案】 Na2Cr2O7 +2NaOH = 2Na2CrO4+ H2O 避免还原时消耗过多盐酸 2CrO42-+CH3OH+10H+=2Cr3++ 7H2O+ CO2↑ 蒸馏法 C 完全溶解于过量的盐酸中 冷却结晶 用乙醚洗涤固体2~3次 80%
【解析】试题分析:(1).根据Cr2O72-+H2O![]() 2CrO42-+2H+,加入氢氧化钠,平衡正向移动,所以Na2Cr2O7与氢氧化钠反应生成Na2CrO4;加40%NaOH过量太多,大量氢氧化钠剩余,造成消耗盐酸过多;(2)在酸性条件下CrO42-被甲醇还原为Cr3+;根据甲醇的沸点低,从剩余溶液中分离出CH3OH;(3)酚酞溶液、石蕊试纸只能判断酸碱性;(4)Cr(OH)3溶于盐酸生成CrCl3,CrCl3溶液浓缩结晶析出CrCl3·6H2O晶体,由于CrCl3·6H2O不溶于乙醚,再用乙醚洗涤、干燥得到得到CrCl3·6H2O。(5)利用关系式Na2Cr2O7 ~~~ CrCl3·6H2O计算产率。
2CrO42-+2H+,加入氢氧化钠,平衡正向移动,所以Na2Cr2O7与氢氧化钠反应生成Na2CrO4;加40%NaOH过量太多,大量氢氧化钠剩余,造成消耗盐酸过多;(2)在酸性条件下CrO42-被甲醇还原为Cr3+;根据甲醇的沸点低,从剩余溶液中分离出CH3OH;(3)酚酞溶液、石蕊试纸只能判断酸碱性;(4)Cr(OH)3溶于盐酸生成CrCl3,CrCl3溶液浓缩结晶析出CrCl3·6H2O晶体,由于CrCl3·6H2O不溶于乙醚,再用乙醚洗涤、干燥得到得到CrCl3·6H2O。(5)利用关系式Na2Cr2O7 ~~~ CrCl3·6H2O计算产率。
解析:(1).根据Cr2O72-+H2O![]() 2CrO42-+2H+,加入氢氧化钠,平衡正向移动,所以Na2Cr2O7与氢氧化钠反应生成Na2CrO4,反应方程式是Na2Cr2O7 +2NaOH = 2Na2CrO4+ H2O;加40%NaOH过量太多,大量氢氧化钠剩余,造成消耗盐酸过多,所以40%NaOH不宜过量太多的原因是,避免还原时消耗过多盐酸;(2)在酸性条件下CrO42-被甲醇还原为Cr3+,反应离子方程式是2CrO42-+CH3OH+10H+=2Cr3++ 7H2O+ CO2↑;利用甲醇的沸点低,从剩余溶液中分离出CH3OH的方法是蒸馏法;(3)酚酞溶液、石蕊试纸只能判断酸碱性,测溶液PH用PH计,故选C;(4)Cr(OH)3溶于盐酸生成CrCl3,CrCl3溶液浓缩结晶析出CrCl3·6H2O晶体,由于CrCl3·6H2O不溶于乙醚,再用乙醚洗涤、干燥得到得到CrCl3·6H2O,所以由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得的洁净固体完全溶解于过量的盐酸中,蒸发浓缩,冷却结晶,过滤,用乙醚洗涤固体2~3次,低温干燥,得到CrCl3·6H2O。
2CrO42-+2H+,加入氢氧化钠,平衡正向移动,所以Na2Cr2O7与氢氧化钠反应生成Na2CrO4,反应方程式是Na2Cr2O7 +2NaOH = 2Na2CrO4+ H2O;加40%NaOH过量太多,大量氢氧化钠剩余,造成消耗盐酸过多,所以40%NaOH不宜过量太多的原因是,避免还原时消耗过多盐酸;(2)在酸性条件下CrO42-被甲醇还原为Cr3+,反应离子方程式是2CrO42-+CH3OH+10H+=2Cr3++ 7H2O+ CO2↑;利用甲醇的沸点低,从剩余溶液中分离出CH3OH的方法是蒸馏法;(3)酚酞溶液、石蕊试纸只能判断酸碱性,测溶液PH用PH计,故选C;(4)Cr(OH)3溶于盐酸生成CrCl3,CrCl3溶液浓缩结晶析出CrCl3·6H2O晶体,由于CrCl3·6H2O不溶于乙醚,再用乙醚洗涤、干燥得到得到CrCl3·6H2O,所以由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得的洁净固体完全溶解于过量的盐酸中,蒸发浓缩,冷却结晶,过滤,用乙醚洗涤固体2~3次,低温干燥,得到CrCl3·6H2O。
(5)设生成CrCl3·6H2O的理论产量是xg,
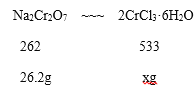
x= 53.3g
CrCl3·6H2O的产率是![]()
