题目内容
6.下列说法正确的是( )| A. | 硅是人类将太阳能转换为电能的常用材料,硅可用于光伏发电、制造芯片 | |
| B. | “84消毒液”(主要成分为次氯酸钠)和洁厕灵(有效成分为盐酸)一起混合使用可增强杀菌消毒的能力 | |
| C. | 油脂是高分子化合物,1mol油脂完全皂化生成n mol甘油和3n mol高级脂肪酸钠 | |
| D. | 鸡蛋清富含蛋白质,将鸡蛋清溶液加热煮沸后蛋白质转化为氨基酸 |
分析 A.依据硅是良好的半导体材料解答;
B.次氯酸钠与盐酸发生氧化还原反应生成氯气;
C.相对分子质量在10000以上的有机化合物为高分子化合物;
D.蛋白质要在催化剂作用下才能水解为氨基酸.
解答 解:A.硅是良好的半导体材料,常用于制造太阳能材料、制造芯片等,故A正确;
B.次氯酸钠与盐酸发生氧化还原反应生成氯气,氯气有毒,所以二者不能混合使用,故B错误;
C.油脂不是高分子化合物,故C错误;
D.将鸡蛋清溶液加热煮沸后,蛋白质发生变性,不会分解生成氨基酸,故D错误;
故选:A.
点评 本题考查了元素化合物知识,熟悉硅、次氯酸、油脂、蛋白质的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
16.在配制100mL 2.0mol/L 的NaCl 溶液时,下列操作会导致结果偏低的是( )
①干净的容量瓶未经干燥就用于配制溶液
②用托盘天平称量时砝码放在左盘
③将烧杯中的溶液转移到容量瓶时,有少量不慎洒到容量瓶外
④定溶时仰视刻度线
⑤定溶时俯视刻度线.
①干净的容量瓶未经干燥就用于配制溶液
②用托盘天平称量时砝码放在左盘
③将烧杯中的溶液转移到容量瓶时,有少量不慎洒到容量瓶外
④定溶时仰视刻度线
⑤定溶时俯视刻度线.
| A. | ②③⑤ | B. | ②③④ | C. | ①③④ | D. | ①③⑤ |
14.下列说法正确的是( )
| A. | 聚氯乙烯的单体是CH2═CHCl | |
| B. | 通过加聚反应得到的聚乙烯属于天然高分子化合物 | |
| C. | 煤的气化是将其通过物理变化转化为气态的过程 | |
| D. | 石油分馏的目的是生产乙烯、丙烯、甲烷等化工原料 |
1.如图为某有机物的结构简式,该有机物不具有的性质是( )
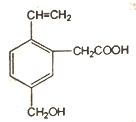

| A. | 能使酸性KMn04溶液褪色 | B. | 能发生酯化反应 | ||
| C. | 能与NaOH溶液反应 | D. | 能发生水解反应 |
11.以下对水的利用过程中主要发生了化学变化的是( )
| A. | 水力发电 | B. | 水变成冰 | C. | 水作冷却剂 | D. | 电解水获得氢气 |
18.下面能说明甲比乙的非金属性强的是( )
①甲比乙容易与H2化合;
②甲单质能与乙的阴离子发生氧化还原反应
③甲的氧化物对应的水化物酸性比乙的氧化物对应的水化物酸性强;
④与某金属反应时甲原子得电子数目比乙的多;
⑤甲的氢化物比乙的氢化物稳定.
①甲比乙容易与H2化合;
②甲单质能与乙的阴离子发生氧化还原反应
③甲的氧化物对应的水化物酸性比乙的氧化物对应的水化物酸性强;
④与某金属反应时甲原子得电子数目比乙的多;
⑤甲的氢化物比乙的氢化物稳定.
| A. | ①④ | B. | ③⑤ | C. | ①②⑤ | D. | ①②④⑤ |
15.电池是人类生产和生活中的重要的能量来源,各式各样电池的发明是化学对人类的一项重大贡献.下列有关电池的叙述正确的是( )
| A. | 构成电池的两极必须是活泼性不同的金属 | |
| B. | 锌锰干电池工作时,电池内部的电流方向由碳棒流向锌桶 | |
| C. | 甲醇燃料电池工作时,甲醇在负极发生氧化反应 | |
| D. | 银锌纽扣电池工作时,电子由锌极流出经过溶液后流向银极 |
6.一定量的乙醛发生银镜反应,析出银21.6g.等量的此醛完全燃烧时,生成的水为( )
| A. | 5.4g | B. | 3.6g | C. | 1.8g | D. | 2.4g |
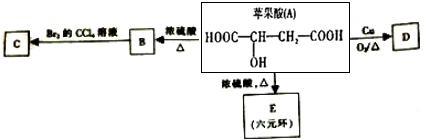
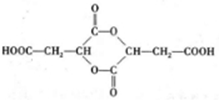 .
. 、
、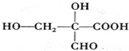 (任一种).
(任一种).