题目内容
18.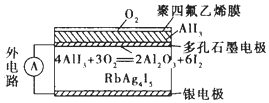 固体离子导体依靠离子迁移传导电流.如图是一种固体电池,Ag+在RbAg4I5晶体中迁移,空气中的O2透过聚四氟乙烯膜与AlI3反应生成I2,Ag和I2作用形成原电池.下列说法错误的是( )
固体离子导体依靠离子迁移传导电流.如图是一种固体电池,Ag+在RbAg4I5晶体中迁移,空气中的O2透过聚四氟乙烯膜与AlI3反应生成I2,Ag和I2作用形成原电池.下列说法错误的是( )| A. | I2与Ag反应属于放热反应 | |
| B. | Ag+从多孔石墨电极向银电极移动 | |
| C. | 多孔石墨电极为正极,银电极为负极 | |
| D. | 银电极的电极反应式为Ag-e-═Ag+ |
分析 Ag和I2作用形成原电池,生成物为RbAg4I5,可知在反应中Ag被氧化,为电池的负极反应,I2被还原,为原电池的正极反应,原电池工作时,阳离子向正极移动,阴离子向负极移动.
解答 解:A.Ag和I2作用形成原电池,原电池反应属于自发的氧化还原反应,则I2与Ag反应属于放热反应,故A正确;
B.原电池工作时,阳离子向原电池正极移动,即Ag+从银极向多孔石墨电电极移动,故B错误;
C.石墨电极为正极,银电极为负极,故C正确;
D.Ag被氧化,为电池的负极反应,银电极的电极反应是:Ag-e-=Ag+,故D正确.
故选B.
点评 本题考查原电池反应,题目难度中等,注意根据生成物判断原电池的正负极,为解答该题的关键,注意原电池的正负极的判断,把握电极反应式的书写.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.下列说法正确的是( )
| A. | 硬脂酸甘油酯皂化反应后得到的主要产品是硬脂酸和甘油 | |
| B. | 氨基酸为高分子化合物,种类较多,分子中都含有-COOH和-NH2 | |
| C. | 鸡蛋清中加入浓的食盐水可以杀菌消毒,发生了蛋白质变性 | |
| D. | 葡萄糖与银氨溶液或含氢氧化钠的氢氧化铜悬浊液的反应可用于检验葡萄糖的存在 |
9. 已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp(CaCO3)=2.8×10-9、Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子).下列说法正确的是( )
已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp(CaCO3)=2.8×10-9、Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子).下列说法正确的是( )
 已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp(CaCO3)=2.8×10-9、Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子).下列说法正确的是( )
已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp(CaCO3)=2.8×10-9、Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子).下列说法正确的是( )| A. | a线代表的是PbCO3 | |
| B. | T℃时,向10 mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+):c(Pb2+)=3×10-5 | |
| C. | d点可以代表CaCO3的饱和溶液,且c(Ca2+)=c(CO32-) | |
| D. | T℃时,向CaCO3悬浊液中加入NH4Cl固体,会使图象中d点向f点转化 |
6.下列叙述不正确的是( )
| A. | 天然气和沼气的主要成分是甲烷 | |
| B. | 等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等 | |
| C. | 油脂和蛋白质在一定条件下都能水解 | |
| D. | 葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物 |
13.下列结论错误的是( )
①微粒半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥沸点:H2Se>H2S>H2O
⑦非金属性:O>N>P>Si
⑧金属性:Be<Mg<Ca<K.
①微粒半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥沸点:H2Se>H2S>H2O
⑦非金属性:O>N>P>Si
⑧金属性:Be<Mg<Ca<K.
| A. | 只有① | B. | ①③⑥ | C. | ②④⑤⑥⑦ | D. | ①③⑤⑥ |
3.下列说法中,正确的是( )
| A. | 煤和石油主要组成元素均为碳、氢元素,二者都是混合物 | |
| B. | 煤的干馏和石油的分馏原理相同,都是化学变化 | |
| C. | 煤的液化主要是为了得到苯等重要的有机化工原料 | |
| D. | 煤的气化是物理变化,目的是获取高效、清洁的燃料 |
7.天然碱的组成可以用aNa2CO3•bNaHCO3•cH2O(a、b、c为整数)表示.现有A、B两种不同的天然碱样品,分别进行如下实验以确定其化学式.
(1)将质量为31.0g的天然碱A于300℃加热分解至完全(300℃时Na2CO3不分解),产生2.24L(标准状况)CO2和5.4g水.天然碱A的化学式中:a=1,b=2,c=2,
(2)已知Na2CO3与稀盐酸的反应分下列两步进行:Na2CO3+HCl→NaCl+NaHCO3,NaHCO3+HCl→NaCl+CO2↑+H2O,将质量为12.45g的天然碱B溶于水,逐滴滴加某浓度的稀盐酸,产生气体的体积与加入盐酸的体积(标准状况)的关系如表所示:
①由表中数据可推测加入50mL盐酸时,产生气体的体积为1120mL(标准状况);盐酸的浓度为2.5mol•L-1;天然碱B的化学式为:2Na2CO3•NaHCO3•2H2O.
②若取W g的天然碱B加入到30mL该浓度的盐酸中,则请用W表示产生产生气体体积V(标准状况,单位:mL)
(1)将质量为31.0g的天然碱A于300℃加热分解至完全(300℃时Na2CO3不分解),产生2.24L(标准状况)CO2和5.4g水.天然碱A的化学式中:a=1,b=2,c=2,
(2)已知Na2CO3与稀盐酸的反应分下列两步进行:Na2CO3+HCl→NaCl+NaHCO3,NaHCO3+HCl→NaCl+CO2↑+H2O,将质量为12.45g的天然碱B溶于水,逐滴滴加某浓度的稀盐酸,产生气体的体积与加入盐酸的体积(标准状况)的关系如表所示:
| 盐酸体积(mL) | 20 | 40 | 60 | 80 |
| 产生气体体积(mL) | 0 | 560 | 1680 | 2520 |
②若取W g的天然碱B加入到30mL该浓度的盐酸中,则请用W表示产生产生气体体积V(标准状况,单位:mL)
8.下列说法正确的是( )
| A. | 甲烷和氯气光照条件下发生取代反应后,得到的有机产物有5种 | |
| B. | 乙烷中混有的少量乙烯,可通入氢气让乙烯和氢气发生加成反应来除去乙烯 | |
| C. | 乙烯和乙炔都能使溴水褪色,但可通过燃烧现象的不同来区别它们 | |
| D. | 氨基酸、蛋白质在一定条件下都能发生水解反应 |