题目内容
煤化工中常需研究不同温度下平衡常数、投料比及产率等问题.
已知:CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如下表:
试回答下列问题
(1)上述反应的正反应是
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率
(3)830℃,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有
(4)830℃时,在2L的密闭容器中加入4molCO(g)和6molH2O(g)达到平衡时,CO的转化率是
已知:CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
(1)上述反应的正反应是
放热
放热
反应(填“放热”或“吸热”).(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率
增大
增大
(填“增大”、“减小”或“不变”),容器内混合气体的压强增大
增大
(填“增大”、“减小”或“不变”).(3)830℃,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有
BC
BC
(选填A、B、C、D).| A | B | C | D | |
| n(CO2) | 3 | 1 | 0 | 1 |
| n(H2) | 2 | 1 | 0 | 1 |
| n(CO) | 1 | 2 | 3 | 0.5 |
| n(H2O) | 5 | 2 | 3 | 2 |
60%
60%
.分析:(1)依据平衡常数随温度的变化结合平衡移动原理分析判断反应的热量变化,根据表中数据可知,温度升高平衡常数减小,说明平衡向逆反应方向移动;
(2)温度升高,反应速率增大,平衡向逆反应方向移动,压强增大;
(3)根据830℃时,平衡常数k=1,依据浓度计算和平衡常数比较判断;
(4)依据平衡三段式列式计算反应的一氧化碳,根据转化率概念计算得到.
(2)温度升高,反应速率增大,平衡向逆反应方向移动,压强增大;
(3)根据830℃时,平衡常数k=1,依据浓度计算和平衡常数比较判断;
(4)依据平衡三段式列式计算反应的一氧化碳,根据转化率概念计算得到.
解答:解:(1)根据表中数据可知,温度升高平衡常数减小,说明平衡向逆反应方向移动,则正反应放热,故答案为:放热;
(2)温度升高,反应速率增大,平衡向逆反应方向移动,反应前后气体体积不变,等容容器中压强之比等于温度之比,所以压强增大,故答案为:增大;增大;
(3)根据830℃时,平衡常数k=1计算;
A、Q=
>1,反应向逆反应方向移动,故A错误;
B、Q=
<1,反应向正反应方向移动,故B正确;
C、只有反应物,反应向正反应方向移动,故C正确;
D、Q=
=1.达到平衡状态,平衡不移动,故D错误.
故答案为:B、C.
(4)830℃时,在2L的密闭容器中加入4molCO(g)和6molH2O(g)达到平衡时,设一氧化碳转化物质的量为x,依据平衡三段式列式得到
CO(g)+H2O(g)?H2(g)+CO2(g)
起始量(mol) 4 6 0 0
变化量(mol) x x x x
平衡量(mol) 4-x 6-x x x
平衡常数K=
=1
x=2.4mol
CO的转化率=
×100%=60%
故答案为:60%.
(2)温度升高,反应速率增大,平衡向逆反应方向移动,反应前后气体体积不变,等容容器中压强之比等于温度之比,所以压强增大,故答案为:增大;增大;
(3)根据830℃时,平衡常数k=1计算;
A、Q=
| 2×3 |
| 5×1 |
B、Q=
| 1×1 |
| 0.5×2 |
C、只有反应物,反应向正反应方向移动,故C正确;
D、Q=
| 1×1 |
| 0.5×2 |
故答案为:B、C.
(4)830℃时,在2L的密闭容器中加入4molCO(g)和6molH2O(g)达到平衡时,设一氧化碳转化物质的量为x,依据平衡三段式列式得到
CO(g)+H2O(g)?H2(g)+CO2(g)
起始量(mol) 4 6 0 0
变化量(mol) x x x x
平衡量(mol) 4-x 6-x x x
平衡常数K=
| x2 |
| (4-x)(6-x) |
x=2.4mol
CO的转化率=
| 2.4mol |
| 4mol |
故答案为:60%.
点评:本题考查化学平衡常数的分析判断,影响因素分析,平衡计算应用,题目难度中等.

练习册系列答案
相关题目
 Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)
Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)| 浓H2SO4 |
| △ |
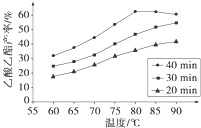
已知CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118℃、78℃和77℃.在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示.(1)该研究小组的实验目的是
(2)60℃下反应40min与70℃下反应20min相比,前者的平均反应速率
(3)如图所示,反应时间为40min、温度超过80℃时,乙酸乙酯产率下降的原因可能是
Ⅱ.煤化工中常需研究不同温度下平衡常数、投料比及热值等问题.
已知:CO(g)+H2O(g)??H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(1)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有
| n(CO) | n(H2O) | n(H2) | n(CO2) | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
C(s)+H2O(g)??CO(g)+H2(g) 平衡常数为K1;
CO(g)+H2O(g)??H2(g)+CO2(g) 平衡常数为K2;
则K、K1、K2之间的关系是
(3)在V L密闭容器中通入10mol CO和10mol水蒸气,在T℃达到平衡,然后急速通过碱石灰,将所得混合气体燃烧,测得放出的热量为2 842kJ(已知CO燃烧热为283kJ?mol-1,H2燃烧热为286kJ?mol-1),则T℃平衡常数K=
 H2(g)+CO2(g)的平衡常数随温度的变化如表:
H2(g)+CO2(g)的平衡常数随温度的变化如表: 2CO(g)平衡常数K;
2CO(g)平衡常数K; CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1; H2(g)+CO2(g) 平衡常数K2,
H2(g)+CO2(g) 平衡常数K2,