题目内容
【题目】某矿抽出的废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO![]() 。某研究性学习小组获取这种废液来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程:
。某研究性学习小组获取这种废液来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程:
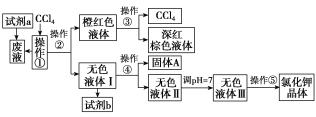
可供试剂a、b的选择试剂:饱和Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2溶液、稀盐酸。(已知:2Br-+2H++H2O2=Br2+2H2O)
请根据以上流程,回答相关问题:
(1)试剂a应该选用_________________。
(2)操作①、②、③、④、⑤的名称是______________________________(填字母)。
A.萃取、过滤、分液、过滤、蒸发 B.萃取、分液、蒸馏、过滤、蒸发
C.分液、萃取、过滤、过滤、蒸发 D.萃取、分液、分液、过滤、蒸发
(3)除去无色液体Ⅰ中的Ca2+、Mg2+、SO![]() ,选出b所代表的试剂,按滴加顺序依次是______________(填化学式)。
,选出b所代表的试剂,按滴加顺序依次是______________(填化学式)。
(4)调节pH的作用是________________,操作方法是_________________。
(5)操作⑤中用到的瓷质仪器的名称是__________________。
【答案】
(1)H2O2溶液(2)B
(3)BaCl2、K2CO3、KOH (或KOH、BaCl2、K2CO3或BaCl2、KOH、K2CO3)
(4)中和过剩的KOH及K2CO3;滴加稀盐酸无无气体产生,用pH试纸测定至pH=7
(5)蒸发皿
【解析】
试题分析:制备流程为:废液中加入双氧水,将溴离子氧化成溴单质,然后加入四氯化碳后通过萃取、分液分离出溴,通过操作③蒸馏得到四氯化碳和溴单质;无色液体Ⅰ中含有K+、Cl-、Ca2+、Mg2+、SO42-,分别加入BaCl2、K2CO3、KOH溶液过滤后得到无色溶液Ⅱ和固体A,再调节溶液Ⅱ的pH萃取碳酸根离子、氢氧根离子,得到无色溶液Ⅲ,最后通过蒸发结晶获得氯化钾固体,
(1)由加入的CCl4及得到的深红棕色液体知,试剂a能将Br-氧化为Br2,试剂a应具有氧化性,所以应选用H2O2溶液。故答案为:H2O2;
(2)由流程图知,无色液体Ⅰ中含有K+、Cl-、Ca2+、Mg2+、SO42-,无色液体Ⅲ中只含有K+、Cl-,则试剂b的作用是除去Ca2+、Mg2+、SO42-;操作①是萃取,操作②是将互不相溶的两种液体分开-分液,操作③是将沸点不同、互溶的两液体分开-蒸馏,操作④是将溶液与沉淀分开-过滤,操作⑤是将KCl从其水溶液中提取出来-结晶,操作①、②、③、④、⑤的名称是:萃取、分液、蒸馏、过滤、蒸发结晶,则B正确。故答案为:B;
(3)由于除杂时除杂试剂需过量,且不能引入新杂质,所以除去Ca2+,选用饱和K2CO3溶液;除去Mg2+,选用KOH溶液;除去SO42-,选用BaCl2溶液.而且只要满足BaCl2溶液在饱和K2CO3溶液之前加入即可。故答案为:BaCl2、K2CO3、KOH(或KOH、BaCl2、K2CO3或BaCl2、KOH、K2CO3);
(4)由以上知,无色液体Ⅱ中还含有杂质离子CO32-和OH-,需用盐酸来除去过量的OH-及CO32-,调节pH=7的操作方法是滴加盐酸,无气体产生时,用pH试纸测定至pH=7。故答案为:中和过剩的KOH及K2CO3;滴加稀盐酸,无气体产生时,用pH试纸测定至pH=7;
(5)由于操作⑤是蒸发结晶,所以该操作用到的瓷质仪器是蒸发皿。故答案为:蒸发皿。

【题目】化学与社会、生活密切相关。对下列现象或事实的解释正确的选项是( )
选项 | 现象或事实 | 解释 |
A | 臭氧能用于杀菌消毒 | 臭氧的还原性使细菌的蛋白质变性 |
B | 铁能用于治疗缺铁性贫血 | 铁能与盐酸生成三氯化铁 |
C | 过氧化钠作呼吸面具中的供氧剂 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
D | 用浸有酸性高锰酸钾的硅藻土作水果保鲜剂 | 高锰酸钾能氧化水果释放的催熟剂乙烯 |
