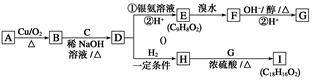
题目内容
| A、①②③ | B、①②⑤ | C、①④⑤ | D、③④⑤ |
②醛基发生加成反应可生成羟基,故②正确;
③酯化反应不能生成羟基,故③错误;
④加聚反应与碳碳双键有关,不能生成羟基,故④错误;
⑤氧化反应可以引入羟基,如醛的氧化反应、烯烃氧化反应,故⑤正确;
故选B.

 发散思维新课堂系列答案
发散思维新课堂系列答案铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁。“速力菲”是市场上一种常见的补铁药品,下表是说明书的部分内容。
|
[规格]每片含琥珀酸亚铁 [适应症]用于缺铁性贫血症,预防及治疗用。 [用量用法]成人预防量 小儿用量预防量 [贮藏]避光、密封、在干燥处保存。 |
(1)该药品中Fe2+会缓慢氧化。国家规定该药物中Fe2+的氧化率(已经被氧化Fe2+的质量与Fe2+总质量的比值)超过10.00% 即不能再服用。
①实验室可采用H2SO4酸化的KMnO4溶液,对“速力菲”中的Fe2+进行滴定(假设药品中其他成份不与KMnO4反应)。请写出该反应的离子方程式: 。
②实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的玻璃仪器除玻璃棒、烧杯、胶头滴管外,还需 。
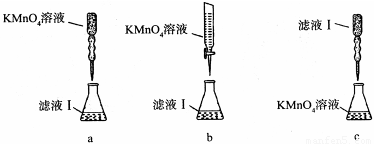
③某同学设计了下列滴定方式(夹持部分略去),最合理的是 。(填字母序号)
(2)称量上述含铁元素质量分数为20.00%的“速力菲”10.00 g ,将其全部溶于稀H2SO4中,配制成1000 ml溶液,取出20.00 ml,用0.01000 mol•L-1的KMnO4溶液滴定,用去KMnO4溶液12.00 ml ,该药品中Fe2+的氧化率为 。
(3)已知琥珀酸为二元有机羧酸,含23.6 g 琥珀酸的溶液与4.0 mol•L-1 100.0 ml的氢氧化钠溶液恰好完全中和。核磁共振氢谱分析显示,琥珀酸分子谱图上只有两组吸收峰。写出琥珀酸溶液与氢氧化钠溶液完全中和的化学方程式(有机物写结构简式) 。
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1 : 1的化合物N是常见的有机溶剂。
请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A2D2分子的电子式为______,E的基态原子的外围电子排布式为______。
(2)B、C、D三种元素的第一电离能由小到大的顺序为______。
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程式为______
(4)下列叙述正确的是______(填序号)。
a. M是极性分子,N是非极性分子 b. M和BD2分子中的中心原子均采用sp2杂化
c. N分子中含有6个σ键和1个π键 d. BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5) 已知:①E的一种氧化物Q,其晶胞结构如图所示

①Q(s)+2Cl2(g)=ECl4(l)+D2(g) △H=+140kJ/mol
②2B(s)+D2(g)=2BD(g) △H=-221kJ/mol
写出物质Q和焦炭、氯气反应生成液态ECI4和BD气体的热化学方程式:__________________________
(6)在0.5 L的密闭容器中,一定量的C2和A2进行如下化学反应:C2(g) +3 A2(g)=2CA3(g) △H <0,其化学平衡常数K与温度t的关系如下表。请回答下列问题。

①试比较K1,K2的大小,K1________K2(填写“ >”、“=”或“<”)。
②在400℃时,当测得CA3和C2、A2的物质的量分别为3mol和1 mol、2 mol时,则该反应的 V(C2)正_________(C2)逆(填写“>”、“=”或“<”)。


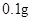
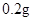 —
—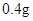 /日。
/日。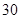 —
—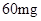 /日,治疗量
/日,治疗量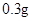 /日
/日