题目内容
【题目】(1)将碳酸钙、稀盐酸、铁、氧气四种物质填写到下面的适当位置。

___________、___________、___________、___________。
(2)从(1)中的四种物质中选出一种或几种为反应物,按下述反应类型,各写一个化学方程式。
①分解反应:_______________________________;
②化合反应:_______________________________;
③置换反应:_______________________________;
④复分解反应:_______________________________。
【答案】碳酸钙 铁 氧气 稀盐酸 CaCO3![]() CaO+CO2↑ 3Fe+2O2
CaO+CO2↑ 3Fe+2O2![]() Fe3O4 Fe+2HClFeCl2+H2↑ CaCO3+2HClCaCl2+H2O+CO2↑
Fe3O4 Fe+2HClFeCl2+H2↑ CaCO3+2HClCaCl2+H2O+CO2↑
【解析】
(1)碳酸钙属于化合物,铁属于金属单质,氧气属于非金属单质,稀盐酸属于混合物;综上所述,本题答案是:碳酸钙, 铁, 氧气, 稀盐酸。
(2) ①CaCO3可以受热分解,反应的方程式为:CaCO3![]() CaO+CO2↑;
CaO+CO2↑;
②Fe和O2可以化合生成Fe3O4:反应的方程式为:3Fe+2O2![]() Fe3O4;
Fe3O4;
③盐酸和铁可以发生置换反应,反应的方程式为:Fe+2HClFeCl2+H2↑ ;
④CaCO3与盐酸可以发生复分解反应,反应的方程式为:CaCO3+2HClCaCl2+H2O+CO2↑;
综上所述,本题答案是:CaCO3![]() CaO+CO2↑;3Fe+2O2
CaO+CO2↑;3Fe+2O2![]() Fe3O4;Fe+2HClFeCl2+H2↑ ;CaCO3+2HClCaCl2+H2O+CO2↑。
Fe3O4;Fe+2HClFeCl2+H2↑ ;CaCO3+2HClCaCl2+H2O+CO2↑。

【题目】氨基羧酸盐在工业、农业、生活中都有着十分广泛的应用。氨基甲酸铵(NH2COONH4)可用做肥料、灭火剂、洗涤剂等,甘氨酸亚铁[(NH2CH2COO)2Fe]可用作补铁剂等。
已知:i. 氨基甲酸铵:白色固体,易分解,易水解;甘氨酸亚铁:易溶于水,难溶于乙醇。
ii. 甘氨酸:易溶于水,微溶于乙醇,两性化合物。
iii. 柠檬酸:易溶于水和乙醇,有较强酸性和还原性。
实验室制备方法如下:
I.制备氨基甲酸铵:反应的化学方程式为:2NH3(g)+CO2(g) ![]() NH2COONH4(g) △H<0
NH2COONH4(g) △H<0
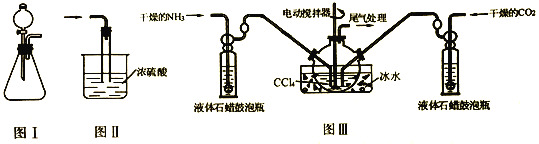
(1)图Ⅰ装置制备NH3,则所选试剂为_________________
(2)图Ⅲ装置制备氨基甲酸铵,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。(注:四氯化碳与液体石蜡均为惰性介质。)
①从反应后的混合物中分离出产品的实验操作是_______________(填操作名称)
②图Ⅱ装置进行尾气处理,则双通玻璃管的作用________________
③液体石蜡鼓泡瓶的作用是________________
④发生器用冰水冷却的原因是________________
II.制备(NH2CH2COO)2Fe:装置如图(夹持和加热仪器已省略), 用CO2气体将装置中空气排净,加入药品后,滴入柠檬酸并加热。反应结束后过滤,将滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品。
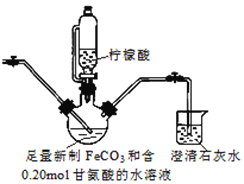
(3)烧杯中澄清石灰水的作用是_______________。
(4)柠檬酸可调节pH,体系pH与产率的关系如下表:
实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 56.68 |
分析pH过低使产率下降的原因是___________;柠檬酸的作用还有_____(填序号)。
a.作反应终点指示剂 b.防止二价铁被氧化 c. 作催化剂 d. 促进FeCO3溶解
(5)乙醇的作用是________________。
(6)若产品的质量为m g,则产率为________________。