题目内容
用下列实验装置进行相应实验,能达到实验目的的是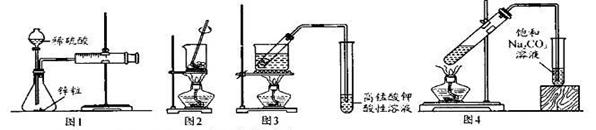
| A.图1--测量锌与硫酸反应的速率 |
| B.图2——灼烧海带成海带灰 |
| C.图3——验证溴乙烷与NaOH乙醇溶液反应生成乙烯 |
| D.图4——实骑室制备收集己酸乙酯 |
A
解析试题分析:A、利用一定时间内生成的气体的体积测量锌与硫酸反应的速率,正确;B、灼烧海带应在坩埚中进行,错误;C、乙醇易挥发且也能使酸性高锰酸钾溶液褪色,所以通入酸性高锰酸钾溶液前应先除去乙醇,错误;D、制备乙酸乙酯时导气管不能伸入液面以下,错误,答案选A。
考点:考查对实验方案的评价

练习册系列答案
相关题目
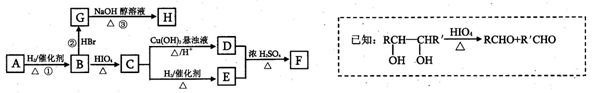
乙烯是来自石油的重要有机化工原料,其产量通常用来衡量一个国家的石油化工发展水平。结合以下路线回答: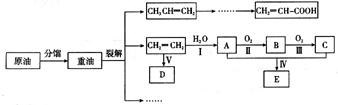
已知: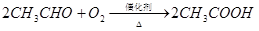
(1)反应II的化学方程式是 。
(2)D为高分子化合物,可以用来制造多种包装材料,其结构简式是 。
(3)E是有香味的物质,在实验室用下图装置制取。
①反应IV的化学方程式是 ,该反应类型为 。
②该装置图中有一个明显的错误是 。
(4)为了证明浓硫酸在反应IV中起到了催化剂和吸水剂的作用,某同学利用上图改进后装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管乙再测有机层的厚度,实验记录如下:
| 实验编号 | 试管甲中试剂 | 试管乙中试剂 | 有机层的厚度/cm |
| A | 2 mL乙醇、1 mL乙酸、 1mL18mol·L-1浓硫酸 | 饱和Na2CO3溶液 | 3.0 |
| B | 2 mL乙醇、1 mL乙酸 | 0.1 | |
| C | 2 mL乙醇、1 mL乙酸、 3 mL 2mol·L-1 H2SO4 | 0.6 | |
| D | 2 mL乙醇、1 mL乙酸、盐酸 | 0.6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是3mL和 mol·L-1。
②分析实验 (填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
下列实验操作完全正确的是
| 编号 | 实验 | 操作 |
| A | 钠与水反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 配制一定浓度的氯化钾溶液1000mL | 准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容 |
| C | 为确证NaHCO3固体中是否含Na2CO3 | 取少量待检固体溶于水中,滴加少量BaC12溶液,观察是否有白色沉淀生成 |
| D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
如图所示为实验室中完成不同的化学实验所选用的装置或进行的操作,其中没有明显错误的
| A 测定中和热 | B 用石灰石和稀盐酸制取CO2 | C 蒸馏石油 | D 配制溶液中转移溶液 |
 | 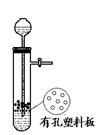 | 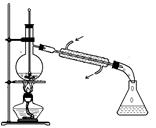 | 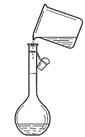 |
利用下图装置处理气体,保持瓶口向上,以下方法正确的是
| A.瓶内是干燥的,由b处进气,收集H2 |
| B.瓶内充满水,由a处进气,收集O2 |
| C.瓶内充满水,由a处进气,用来测量NH3的体积 |
| D.瓶内装入浓硫酸,由 b处进气,用来干燥H2S气体 |
关于下列图示装置的描述中,正确的是
① ② ③ ④
| A.装置①中,c为阴极,d为阳极 |
| B.装置②可用于实验室蒸馏石油 |
| C.装置③中的X为CCl4时,可用于吸收氯化氢气体,并防止倒吸 |
| D.装置④可用于收集氨气及并进行尾气吸收 |

 。化合物
。化合物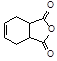 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以 和
和 为原料合成该化合物(用合成路线流程图表示,并注明反应条件)。合成路线流程图示例如下:
为原料合成该化合物(用合成路线流程图表示,并注明反应条件)。合成路线流程图示例如下: