题目内容
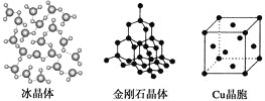
【题目】下列各图为几种晶体或晶胞的构型示意图。

请回答下列问题:
(1)这些晶体中,粒子之间以共价键结合形成的晶体是_______________________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为_________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能________(填“大于”或“小于”)MgO晶体的晶格能,原因是___________________________________________。
(4)每个Cu晶胞中实际占有________个Cu原子,CaCl2晶体中Ca2+的配位数为________。
(5)冰的熔点远高于干冰的重要原因是___________________________________。
【答案】 金刚石晶体 金刚石>MgO>CaCl2>冰>干冰 小于 MgO晶体中离子的电荷数大于NaCl晶体中离子电荷数;且r(Mg2+)<r(Na+)、r(O2-)<r(Cl-) 4 8 H2O分子之间存在氢键
【解析】(1)原子晶体中原子间以共价键结合,则粒子之间以共价键结合形成的晶体是金刚石晶体;(2)熔点的一般规律:原子晶体>离子晶体>分子晶体,冰和干冰属于分子晶体,熔点:冰>干冰,MgO和CaCl2属于离子晶体,熔点:MgO>CaCl2,金刚石是原子晶体,则熔点由高到低的顺序为:金刚石>MgO>CaCl2>冰>干冰;(3)因为MgO中离子带两个电荷,NaCl中离子带一个电荷,氧离子半径小于氯离子,根据离子半径越小,离子带电荷越多,晶格能越大,可得NaCl晶体的晶格能小于MgO晶体的晶格能,故答案为:MgO晶体中离子的电荷数大于NaCl晶体中离子电荷数;且r(Mg2+)<r(Na+)、r(O2-)<r(Cl-);(4)Cu原子占据面心和顶点,则每个Cu晶胞中实际占有的原子数为8×![]() +6×
+6×![]() =4;根据氯化钙的晶胞图可知,每个Ca2+周围有8个Cl-,而每个Cl-周围有4个Ca2+,所以CaCl2晶体中Ca2+的配位数为8;(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,水分子间含有氢键,氢键的作用力大于范德华力,所以其熔沸点较高;故答案为:H2O分子之间能形成氢键。
=4;根据氯化钙的晶胞图可知,每个Ca2+周围有8个Cl-,而每个Cl-周围有4个Ca2+,所以CaCl2晶体中Ca2+的配位数为8;(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,水分子间含有氢键,氢键的作用力大于范德华力,所以其熔沸点较高;故答案为:H2O分子之间能形成氢键。

 寒假学与练系列答案
寒假学与练系列答案