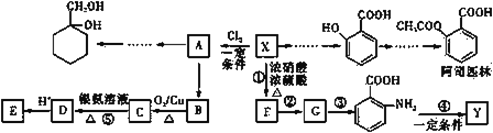
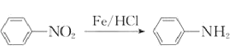
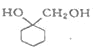
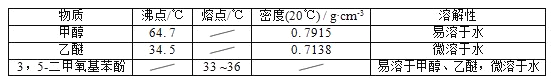
题目内容
【题目】镍-铁碱性电池十分耐用,但其充电过程中正负极得到的产物对电解水有很好的催化作用,因此电池过充时会产生氢气和氧气,限制了其应用。科学家将电池和电解水结合在起,制成新型的集成式电池电解器,可将富余的能量转化为氢能储存。已知镍铁碱性电池总反应方程式为:Fe+2NiOOH+2H2O![]() Fe(OH)2+2Ni(OH)2。下列有关说法错误的是( )
Fe(OH)2+2Ni(OH)2。下列有关说法错误的是( )
A.电能、氢能属于二次能源
B.该储能装置中的交换膜为阴离子交换膜
C.该装置储氢能发生的反应为:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
D.镍-铁碱性电池放电时正极的反应为:Ni(OH)2+OH--e-═NiOOH+H2O
【答案】D
【解析】
A.电能、氢能都是由其他能源转化得到的能源,为二次能源,故A正确;
B.电解时氢氧根离子通过离子交换膜进入阳极,在阳极失电子生成氧气,则该储能装置中的交换膜为阴离子交换膜,故B正确;
C.该装置储氢时,发生电解水的反应,电解水生成氢气和氧气,即反应为:2H2O![]() 2H2↑+O2↑,故C正确;
2H2↑+O2↑,故C正确;
D.正极上发生得电子的还原反应,则镍-铁碱性电池放电时正极的反应为:Ni(OH)2+OH-+e-═NiOOH+H2O,故D错误。
故选:D。

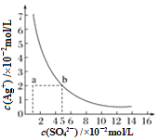
【题目】已知:I2+2S2O32-=S4O62-+2I-;CuI是不溶于水的白色沉淀。
相关物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入_________,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是(用文字叙述):____________________________________________。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是______________________________。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用_______________作滴定指示剂,滴定终点的现象是________________________。
②CuCl2溶液与KI反应的离子方程式为___________________________________________。
③该试样中CuCl2·2H2O的质量百分数为__________________