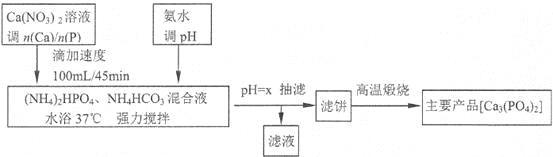
题目内容
【题目】软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4·H2O,反应的化学方程式为MnO2+SO2MnSO4。
(1)质量为17.40 g纯净MnO2最多能氧化____L(标准状况)SO2。
(2)已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10-6mol·L-1),需调节溶液pH范围为____。
(3)下图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制结晶温度范围为____。

(4)准确称取0.171 0 g MnSO4·H2O样品置于锥形瓶中,加入适量H3PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用c(Fe2+)=0.050 0 mol·L-1的标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗Fe2+溶液20.00 mL。计算MnSO4·H2O样品的纯度(请给出计算过程)_____。
【答案】4.48 5.0<pH<7.1 高于60℃ 根据氧化还原反应中得失电子守恒: n(Mn3+)×1=n(Fe2+)×1=20.00×10-3L×0.050 0 mol·L-1=1.00×10-3mol,根据锰元素守恒,m(MnSO4·H2O)=1.00×10-3mol×169 g·mol-1=0.169g,样品的纯度是![]() ×100%≈98.8%
×100%≈98.8%
【解析】
(1)根据MnO2+SO2=MnSO4可知,n(SO2)=n(MnO2);
(2)pH=7.1时Mn(OH)2开始沉淀.室温下,除去MnSO4溶液中的Fe3+、Al3+,结合Al(OH)3完全变成沉淀时的pH、Fe(OH)3完全变成沉淀时的pH分析;
(3)从MnSO4和MgSO4混合溶液中结晶MnSO4H2O晶体,根据图上信息,高于60℃以后MnSO4H2O的溶解度减小,而MgSO46H2O的溶解度增大,因此控制结晶温度范围是高于60℃;
(4)根据氧化还原反应中得失电子守恒:n(Mn3+)×1=n(Fe2+)×1=0.02L×0.0500mol=1.00×10-3mol,根据Mn元素守恒,m(MnSO4H2O)=1.00×10-3mol×169g/mol=0.169g,以此计算纯度。
(1)根据反应方程式,n(SO2)=n(MnO2)= ![]() mol=0.2mol,因此V(SO2)=0.2×22.4L=4.48L;
mol=0.2mol,因此V(SO2)=0.2×22.4L=4.48L;
(2)制备MnSO4,再根据信息,pH小于7.1,氢氧化铝完全变成沉淀时的pH:Ksp[Al(OH)3]=1×10-33=c(Al3+)×c3(OH-),c(Al3+)=1×10-6mol·L-1,得出:c(OH-)=1×10-9mol·L-1,c(H+)=Kw/c(OH-)=10-5,pH=5,同理计算出Fe(OH)3完全变成沉淀时,pH约为3.5,故范围是:5.0<pH<7.1;
(3)从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,根据图上信息,高于60℃以后MnSO4·H2O的溶解度减小,而MgSO4·6H2O的溶解度增大,因此控制结晶温度范围是高于60℃,这样可以得到纯净的MnSO4·H2O;
(4)根据氧化还原反应中得失电子守恒:n(Mn3+)×1=n(Fe2+)×1=20.00×10-3×0.0500mol=1.00×10-3mol,根据Mn元素守恒,m(MnSO4·H2O)=1.00×10-3×169g=0.169g,纯度是:![]() ×100%=98.8%。
×100%=98.8%。

【题目】研究![]() 、
、![]() 、
、![]() 等的处理方法对环境保护有重要意义。
等的处理方法对环境保护有重要意义。
(1)科学家正在研究利用催化技术将尾气中的NO和CO转变成![]() 和
和![]() ,其反应为:
,其反应为:![]()
![]()
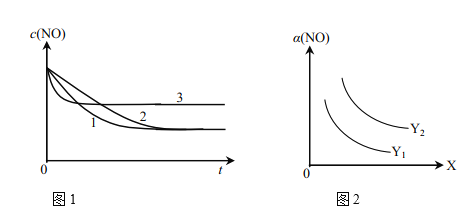
①为了研究外界条件对该反应的影响,进行下表三组实验,测得不同时刻NO的浓度(c)随时间变化的趋势如图1所示。1、2、3代表的实验编号依次是________。(已知在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。)
实验温度NO初始浓度O初始浓度催化剂比表面积催化剂用量编号(℃)
实验 编号 | 温度 (℃) | NO初始浓度
| CO初始浓度
| 催化剂比表面积
| 催化剂用量 (g) |
Ⅰ | 280 |
|
| 82 | 50 |
Ⅱ | 280 |
|
| 124 | 50 |
Ⅲ | 350 |
|
| 124 | 50 |
②图2表示NO的平衡转化率(a)随温度、压强变化的示意图。X表示的是________,理由是________;Y表示的是________,且Y1________Y2(填“>”或“<”)。
(2)一定温度下,将![]() 与
与![]() 以体积比1:2置于密闭容器中发生反应
以体积比1:2置于密闭容器中发生反应![]() ,达到平衡时
,达到平衡时![]() 的体积分数为25%。该反应的平衡常数
的体积分数为25%。该反应的平衡常数![]() ________。
________。
(3)利用原电池反应可实现![]() 的无害化,总反应为
的无害化,总反应为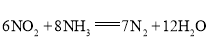 ,电解质溶液为碱性。工作一段时间后,该电池负极区附近溶液pH________(填“变大”、“变小”或“不变”),正极电极反应式为________。
,电解质溶液为碱性。工作一段时间后,该电池负极区附近溶液pH________(填“变大”、“变小”或“不变”),正极电极反应式为________。
【题目】I.2017年5月5日,中国首架按照国际标准研制的拥有自主知识产权的大型客机C-919在上海浦东机场首飞,科学家在实验室中研究的利用催化技术将飞机尾气中的NO和CO转变成CO2和N2的反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H<0。
N2(g)+2CO2(g)△H<0。
(1)若将1mol NO和2mol CO通入2L的恒容密闭容器中,在一定条件下发生上述反应,反应中生成的N2的物质的量浓度随时间的变化情况如图1所示。则NO从反应开始到平衡时的平均反应速率v(NO)=__________,4min末CO的浓度为__________mol·L-1。
(2)已知上述反应中NO的平衡转化率与压强、温度的关系如图2所示。工业上催化装置中比较适合的温度和压强是__________

II.取50 mL0.50mol·L-1NaOH溶液和50 mL、0.50mol/L硫酸溶液进行中和热测定实验,实验数据如下表:
(1)请填写表中的空白:
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | __________ |
2 | 27.0 | 27.4 | 27.2 | 31.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 31.4 | |
(2)近似认为0.50mol·L-1 NaOH 溶液和0.50mol·L-1硫酸溶液的密度都是1g·cm-3,中和后生成溶液的比热容c =4.18J·g-1·℃-1。则中和热△H=__________。(取小数点后一位)
(3)上述实验数值结果与57.3kJ·mol-1有偏差,产生偏差的原因可能是__________(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度