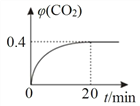
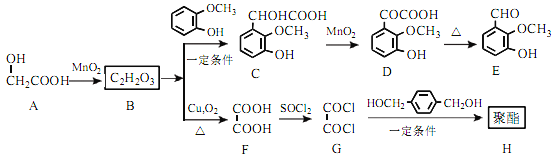
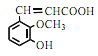题目内容
【题目】若某基态原子的外围电子排布为3d14s2,则下列说法正确的是( )
A. 该元素属于P区B. 该元素原子核外有4个电子层
C. 该元素原子最外层共有3个电子D. 该元素原子M能层共有8个电子
【答案】B
【解析】
A.若某基态原子的外围电子排布为3d14s2,则原子核外电子排布式是[Ar] 3d14s2,质子数是21,是Sc元素,属于d区元素,A错误;
B.该元素最大能层为4,所以该元素原子核外有4个能层,即有4个电子层,B正确;
C.由价层电子排布式可知该元素原子最外层共有2个电子,C错误;
D.该元素原子M能层共有9个电子,D错误;
故合理选项是B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目