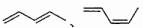题目内容
(2012?海南)能正确表示下列反应的离子方程式为( )
分析:A.反应还应该有CaCO3生成;
B.ClO-具有强氧化性;
C.还有BaSO4生成;
D.根据质量守恒定律和电荷守恒定律解题.
B.ClO-具有强氧化性;
C.还有BaSO4生成;
D.根据质量守恒定律和电荷守恒定律解题.
解答:解:A.溶液中有钙离子,能与CO32-反应生成CaCO3,故A错误;
B.ClO-具有强氧化性,能将二氧化硫氧化为硫酸根,离子方程式:SO2+ClO-+2OH-=SO42-+Cl-+H2O,故B正确;
C.Ba2+可与硫酸根反应生成硫酸钡沉淀,故C错误;
D.产物、元素、电荷都守恒,故D正确.
故选BD.
B.ClO-具有强氧化性,能将二氧化硫氧化为硫酸根,离子方程式:SO2+ClO-+2OH-=SO42-+Cl-+H2O,故B正确;
C.Ba2+可与硫酸根反应生成硫酸钡沉淀,故C错误;
D.产物、元素、电荷都守恒,故D正确.
故选BD.
点评:本题是一道关于离子方程式书写正误的判断题,注意量的多少对反应的影响,是现在考试的热点,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
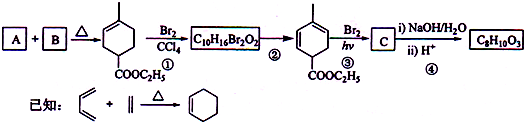
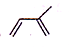
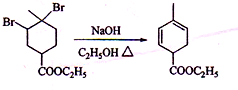
 (2012?海南)实验室制备1,2-二溴乙烷的反应原理如下:
(2012?海南)实验室制备1,2-二溴乙烷的反应原理如下: