题目内容
【题目】C、O、N、C1是重要的非金属元素,它们的单质和化合物有重要应用。回答下列问题:
(1)C、O、N、C1四种元素中基态原子未成对电子数最多的是_______,C、O、C1原子得到电子时放出热量,而N原子得到电子却吸收热量的原因是_________。
(2)NO3-的空间构型为__________;H2O分子中H—O键键角小于NH3分子中N—H键键角的原因是__________________。
(3)CO可形成多种配位化合物,CO的结构是为_______,与CO互为等电子体且带1个单位负电荷的阴离子化学式为____________________。
(4)C元素的单质石墨烯的结构可以看作是单层的石墨,其中碳原子的杂化方式为______________;C60的晶体结构类似于干冰,则每个C60晶胞的质量为_______g(用含NA的式子表示)。
(5)NaC1晶体的结构如右图所示。已知:NaC1晶体的密度为a g·cm-3,则NaC1晶体中最近两个Na+的距离的数学表达式为_______cm(用含a、NA的式子表示)。

【答案】 N N的核外电子排布为1s22s22p3,2p轨道半充满,比较稳定;如果得到电子,破坏稳定状态,需要吸收能量。 平面三角形 H2O中O有两对孤对电子,NH3中N只有一对孤对电子,H2O中孤对电子对成键电子的排斥力更大,因而键角变得更小。 C≡O CN- sp2 ![]()
![]()
【解析】(1)N元素基态原子核外电子排布式为1s22s22p3,2p 轨道为半充满,比较稳定,3个电子在三个轨道中排布,故未成对电子数为3个;C、O、C1的未成对电子数分别为0、0、1,故未成对电子数最多的是N;N的核外电子排布为1s22s22p3,2p轨道半充满,比较稳定;如果得到电子,破坏稳定状态,需要吸收能量,故C、O、C1原子得到电子时放出热量,而N原子得到电子却吸收热量;(2)N原子形成3个δ键,孤对电子数=![]() =0,所以中心原子为sp2杂化,立体构型为平面三角形;H2O中O有两对孤对电子,NH3中N只有一对孤对电子,H2O中孤对电子对成键电子的排斥力更大,因而键角变得更小,故H2O分子中H—O键键角小于NH3分子中N—H键键角;(3)CO分子的结构和N2相似,是三键结构:C≡O;等电子体指价电子数和原子数(氢等轻原子不计在内)相同的分子、离子或基团。与CO互为等电子体且带1个单位负电荷的阴离子化学式为CN-;石墨烯的结构可以看作是单层的石墨,其中碳原子以sp杂化轨道组成六角型呈蜂巢晶格的平面薄膜;C60晶体为面心立方排布,所以每个C60晶胞有4个分子(面心3个,顶点1个),所以一个C60晶胞=
=0,所以中心原子为sp2杂化,立体构型为平面三角形;H2O中O有两对孤对电子,NH3中N只有一对孤对电子,H2O中孤对电子对成键电子的排斥力更大,因而键角变得更小,故H2O分子中H—O键键角小于NH3分子中N—H键键角;(3)CO分子的结构和N2相似,是三键结构:C≡O;等电子体指价电子数和原子数(氢等轻原子不计在内)相同的分子、离子或基团。与CO互为等电子体且带1个单位负电荷的阴离子化学式为CN-;石墨烯的结构可以看作是单层的石墨,其中碳原子以sp杂化轨道组成六角型呈蜂巢晶格的平面薄膜;C60晶体为面心立方排布,所以每个C60晶胞有4个分子(面心3个,顶点1个),所以一个C60晶胞=![]() =
=![]() ;(5)食盐的晶体结构为:该晶胞中氯离子数目为:1+
;(5)食盐的晶体结构为:该晶胞中氯离子数目为:1+![]() ×12=4,钠离子数目为:
×12=4,钠离子数目为: ![]() ×8+
×8+![]() ×6=4,设该晶胞的边长为x,则距离最近的钠离子距离为
×6=4,设该晶胞的边长为x,则距离最近的钠离子距离为![]() ,根据该晶胞的体积和质量计算得:ax3=
,根据该晶胞的体积和质量计算得:ax3=![]() ×4 整理得:x3=
×4 整理得:x3=![]() ,x=
,x=![]() ,即距离最近的钠离子距离为
,即距离最近的钠离子距离为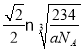 。
。

【题目】下列实验中,实验现象及结论都正确且两者具有因果关系的是
实验 | 现象 | 结论 | |
A | 向Ba(NO3)2溶液中通入二氧化硫气体 | 有白色沉淀生成 | SO2与Ba(NO3)2反应得到BaSO3 |
B | 向FeI2的溶液中滴加少量的氯水 | 溶液颜色变深 | Cl2与Fe2+反应生成Fe3+ |
C | 向蔗糖溶液中加几滴稀硫酸,水浴加热5min后,再加新制Cu(OH)2后加热 | 无砖红色沉淀生成 | 蔗糖没有水解 |
D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
A. A B. B C. C D. D