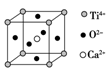
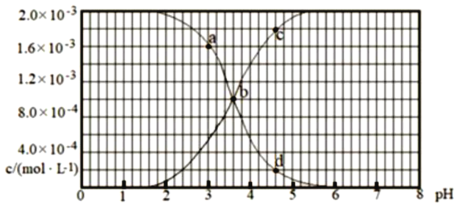
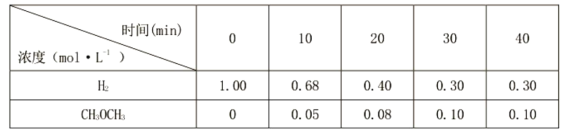
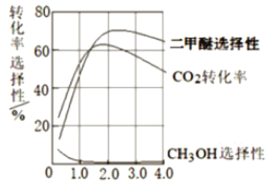
��Ŀ����
����Ŀ���Ȼ���ͭ(CuCl)�������й㷺����������ɱ��������ɫ����ij��ȤС����ü��ȷֽ��Ȼ�ͭ����(CuCl2��xH2O)�ķ����Ʊ�CuCl����װ������(�г�����ʡ��)��

��֪��
���������գ�
(1)��ʵ������У����Թ۲쵽C����ֽ����ɫ�仯��___________________________��
(2)ʵ���������Ҫȫ��ͨ������HCl����������___________________________��
(3)��Ӧ������ȡ��CuCl��Ʒ����ʵ�飬�������к������������ʣ�������֪��Ϣ
�� ��������CuCl2���������ԭ�������____________________________________��
�� ��������CuO���������ԭ�������_____________________________________��
(4)Ϊ�ⶨԭ��CuCl2��xH2O�нᾧˮ����Ŀx���ɲ�ȡ���·�����
a���õ�����ƽ��ȡһ�������Ȼ�ͭ���� b����______(����������)�г������
c���ڸ���������ȴ d���������ú�ɫ��������
e���ظ�b ~ d����ֱ��_____________________
�� �������ʵ��������衣
�� ���Ȼ�ͭ��������Ϊ3.384 g�����յõ���ɫ��������Ϊ1.600 g����x =________(��ȷ��0.1)��
�� �����������������ղⶨ�����������Ϊ1.5%��д�����ܵ��¸ý����һ�������____________________________
���𰸡��ȱ�죬����ɫ ����CuCl2��ˮ�⣬������ˮ���� ����ʱ�䲻����¶ȹ��� ͨ��HCl�������� ���� �������γ�����ֵ������0.001 g 1.9 ����ʱ�й��彦��
��������
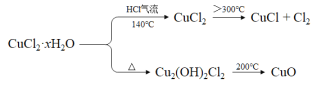
������֪��Ϣ���ȷֽ�CuCl2��xH2O�Ʊ�CuCl��Ϊ����ˮ�⣬���������Ҫͨ��HCl���壬Ȼ�����A���Թܣ�B�����θ��������ˮ����ͭ����������֪��CuCl2��xH2O�ֽ�������ˮ������2CuCl2 ![]() 2CuCl+ Cl2�������C��ʪ�����ɫʯ����ֽ�ȱ�����ɫ��D��NaOH��Һ��������β������ֹ��Ⱦ���ݴ˷������
2CuCl+ Cl2�������C��ʪ�����ɫʯ����ֽ�ȱ�����ɫ��D��NaOH��Һ��������β������ֹ��Ⱦ���ݴ˷������
(1)����������������ʵ������У����Թ۲쵽C����ֽ����ɫ�仯���ȱ�죬����ɫ���ʴ�Ϊ���ȱ�죬����ɫ��
(2)������֪��Ϣ��CuCl2��xH2O�ڼ���ʱ�ܹ�ˮ�����ɼ�ʽ�Ȼ�ͭ��ʵ���������Ҫȫ��ͨ������HCl����Ϊ������CuCl2��ˮ�⣬������ˮ�������ʴ�Ϊ������CuCl2��ˮ�⣬������ˮ������
(3)��Ӧ������ȡ��CuCl��Ʒ����ʵ�飬�������к������������ʡ�
�� ��������CuCl2��������֪��Ϣ��CuCl2 ת��ΪCuCl����Ҫ��300�����ϵ��¶��½��У�����CuCl2���¶Ȳ��������ʱ�䲻���йأ��ʴ�Ϊ������ʱ�䲻����¶ȹ��ͣ�
�� ��������CuO��CuCl2��xH2O�ڼ���ʱ�ܹ�ˮ�����ɼ�ʽ�Ȼ�ͭ����ʽ�Ȼ�ͭ���ȷֽ���������ͭ����˻���CuO��û����HCl�ķ�Χ�м��Ȼ���δ���Թ���ȴ��ֹͣͨ��HCl�����йأ��ʴ�Ϊ��ͨ��HCl�������㣻
(4)�ٲⶨԭ��CuCl2��xH2O�нᾧˮ����Ŀx�������������г������һ�������Ȼ�ͭ���壬�ڸ���������ȴ���������ú�ɫ����������ֱ���������γ�����ֵ������0.001 g���ʴ�Ϊ���������������γ�����ֵ������0.001 g��
�����յõ���ɫ����Ϊ����ͭ������ͭ����Ϊ1.600 g�����ʵ���=![]() =0.02mol������ͭԪ���غ㣬������CuCl2������=0.02mol��135g/mol=2.7g����ᾧˮ������=3.384 g-2.7g=0.684g�����ʵ���=
=0.02mol������ͭԪ���غ㣬������CuCl2������=0.02mol��135g/mol=2.7g����ᾧˮ������=3.384 g-2.7g=0.684g�����ʵ���=![]() =0.038mol����x=
=0.038mol����x=![]() =
=![]() =1.9���ʴ�Ϊ��1.9��
=1.9���ʴ�Ϊ��1.9��
�����ղⶨ�����������Ϊ1.5%��˵����ʵ�����ƫ�������Ϊ����ʱ�й��彦���ȣ��ʴ�Ϊ������ʱ�й��彦��(�𰸺�������)��

 ��Ȥ������ҵ���ϿƼ�������ϵ�д�
��Ȥ������ҵ���ϿƼ�������ϵ�д�